Crescimento e proliferação de tumores
Em circunstâncias normais, o mTOR é um grande regulador do crescimento e divisão celular. Contudo, nas células tumorais, o mTOR anormalmente activado envia sinais que encorajam as células tumorais a crescer, a metástase e a invadir novos tecidos saudáveis . Entre eles, o PI3K/phosphate e a homologia de fungos eliminados na via do cromossoma 10 (PTEN)/AKT/TSC é o principal activador do mTORC1, e as mutações genéticas nesta via podem levar a tumores malignos . Além disso, a expressão do PTEN é frequentemente eliminada por modificação epigenética, genética e pós-transcripcional para regular a via PI3K/Akt/mTOR na maioria dos tumores malignos .
Hou et al. descobriram que as mutações no gene PTEN levaram à activação anormal da via PI3K/PTEN no carcinoma de células hepáticas (HCC). Além disso, a eliminação do gene PTEN induz a expressão do B7-H1, que leva à imunossupressão e aumenta a progressão e invasão tumoral. No cancro do fígado, a via PI3K/PTEN/Akt/mTOR activada está envolvida na invasão e metástase tumoral por up-regulating metallopeptidase 9 (MMP-9) de matriz reguladora. Do mesmo modo, a via de sinalização PI3K/Akt/mTOR foi encontrada para controlar a proliferação e sobrevivência das células estaminais do cancro do cólon (CCSC). No cancro do cólon esporádico, a CCSC pode causar recidiva e metástase . Xie et al. descobriram que a mutação do gene da cinase hepática B1 (LKB1) ou o sinal de crescimento extracelular pode activar o mTORC1. O MTORC1 inibe a actividade da proteína do dedo anelar 168 (RNF168) e promove a sua degradação através da fosforilização da 60ª serina de RNF168. Isto reduzirá significativamente a modificação da ubiquitinação do membro da família histone H2A e H2A histone X (H2AX) após danos no ADN, o que inibirá a resposta aos danos no ADN e reduzirá a estabilidade do genoma, levando à promoção da transformação de células malignas e do cancro. Além disso, a investigação existente mostra que Rheb é uma GTPase que liga e activa o mTORC1 quando o GTP é carregado. Deng et al. relataram que a ubiquitinação de Rheb foi regulada por sinais de factores de crescimento. A ubiquitina de Rheb inibe a actividade de Rheb ao promover a ligação de Rheb ao TSC2, levando à inibição da expressão de mTORC1. Para além da via mTORC1, a via mTORC2 também está envolvida na regulação da ocorrência e desenvolvimento de células tumorais. Wang et al. demonstraram que a OTU deubiquitinase 7B (OTUD7B) reduziu o nível de ubiquitinação de GβL para evitar que GβL interaja com o SIN1, levando à activação da via de sinalização mTORC2/AKT e à desregulação da expressão mTORC1. Isto activa parcialmente a sinalização oncogénica AKT e promove a tumorigenese. Contudo, a ubiquitina ligase TNF Receptor Associado Factor 2 (TRAF2) tem o efeito oposto, aumentando o nível de ubiquitinação GβL. Da mesma forma, Kovalski et al. provaram que as mutações Ras podem ligar-se ao mTOR da proteína associada à mTORC2 e à proteína associada à kinase-cina 1 activada por mitógeno (MAPKAP1) para promover a actividade da kinase mTORC2, iniciando assim programas de transcrição do ciclo celular proliferativo a jusante.
Em resumo, a mTOR é sempre estimulada nos tumores para manter o crescimento, sobrevivência e proliferação de células tumorais, e desempenha um papel fundamental na biologia das células tumorais (Fig. 1).
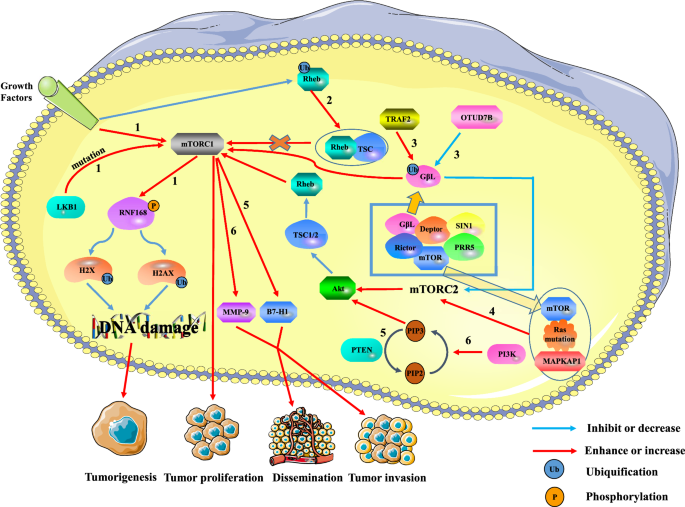
a relação entre o mTOR e os tumores. A sobreactivação do mTORC1 pode promover a formação, proliferação e metástase do tumor, enquanto que o mTORC2 pode regular a expressão do mTORC1 através da via mTORC2/AKT/TSC/Rehb. Caminho 1: Os sinais de crescimento extracelular e as mutações intracelulares LKB1 activam o mTORC1, o que reduz a ubiquitinação do histone H2A e H2A após danos de ADN por fosforilação RNF168. Isto pode levar a danos na reparação do ADN e promover a formação de tumores. Via 2: A ubiquitinação de Rheb reduz a actividade de Rheb ao promover a ligação de Rheb ao TSC2. A desregulação de Rheb reduz a activação de mTORC1, levando à inibição do crescimento do tumor. Caminho 3: TRAF2 e Otud7B respectivamente regulam a actividade de mTORC1/2, regulando o nível de ubiquitinação de G beta L da mTORC2. TRAF2 aumentou a actividade da mTORC1 e inibiu a actividade da mTORC2. Embora a desregulação da expressão mTORC2 inactiva a via AKT/TSC/Rehb/mTORC1, a actividade global da mTORC1 é melhorada. No entanto, Otud7B tem o efeito oposto no TRAF2. Percurso 4: Ras mutado liga mTOR e MAPKAP1 de mTORC2 para promover a expressão mTORC2. O up-regulation do mTORC2 promove a proliferação tumoral através da via AKT/TSC/Rehb/mTORC1. Caminho 5: A eliminação do gene PTEN induz a expressão de B7-H1 para aumentar a progressão e invasão tumoral. Via 6: A via PI3K/PTEN/AKT/mTOR está envolvida na invasão e metástase do cancro do fígado através do aumento da regulação de MMP-9
Metabolismo do tumor
mTOR é activado quando os nutrientes são suficientes, o que promove o anabolismo e o armazenamento e utilização de energia. Quando os nutrientes são relativamente escassos, o organismo deve inibir a activação do mTOR para manter estável o material celular e a energia. As células tumorais requerem grandes quantidades de proteínas, lípidos, e nucleótidos para responder às suas necessidades de crescimento e divisão . Portanto, a actividade anormal da via do mTOR ocorre frequentemente em tumores, porque o mTOR desempenha um papel fundamental na regulação do metabolismo.
Nas células cancerosas da mama, a via PI3K/AKT/mTORC1/sterol da proteína de ligação ao elemento regulador (SREBP) é o principal mecanismo para induzir uma nova síntese lipídica e promover a proliferação tumoral . A kinase piruvada (PK) está envolvida no metabolismo do açúcar, enquanto a sintetase de ácidos gordos (FASN) está envolvida na síntese de ácido gordo (FA). Tao et al. descobriram que a desregulação da expressão da quinase piruvada M2 (PKM2) desactiva a via de sinalização AKT/mTOR, reduzindo assim a expressão da SREBP-1c. O reduzido nível de expressão da SREBP-1c inibe a geração de FA ao inibir a transcrição do gene FASN, resultando no crescimento inibido de células tumorais. Além disso, Di Malta et al. relataram que o gene TFE (up-regulated transcription factor enhancer) pode activar a via Rag GTPase/mTORC1. Nas células normais, esta via é activada para que as células possam absorver melhor os nutrientes para manter as funções fisiológicas. Nas células tumorais, esta via é frequentemente sobre-activada para satisfazer as necessidades nutricionais das células tumorais em rápido crescimento. Contudo, Guri et al. exploraram que o mTORC2 promoveu a produção de esfingomielina e cardiolipina no HCC. Por um lado, a esfingomielina e os fosfolipídios cardíacos são ambos componentes estruturais dos biofilmes celulares. Por outro lado, o metabolismo e o transporte dos fosfolípidos cardíacos contribuem para o bom funcionamento das mitocôndrias, pelo que devem ser fornecidos em grandes quantidades em células tumorais em rápida proliferação. Estes resultados sugerem que a via de sinalização mTORC2 promove a proliferação de HCC e a produção de lípidos relacionados com a energia.
Como mencionado acima, os metabolismos das células tumorais podem ser regulados pela via mTOR para satisfazer as suas necessidades proliferativas e nutricionais. Por outro lado, o metabolismo das células tumorais pode também promover o crescimento tumoral através da via do mTOR. Ericksen et al. demonstraram que a redução da decomposição do aminoácido de cadeia ramificada (BCAA) poderia promover a ocorrência e o desenvolvimento de tumores, aumentando a actividade do mTORC1. Concluíram também que a actividade da enzima chave no processo de catabolismo do BCAA estava altamente correlacionada com a invasão tumoral. Portanto, a acumulação de BCAAs causada pela inibição do catabolismo de BCAA nos tecidos tumorais do fígado pode ser o mecanismo primário da activação crónica da mTORC1 tumoral. Da mesma forma, Shi et al. mostraram que a expressão do receptor de adenosina A2a (A2aR) nos tecidos do cancro gástrico (GC) foi aumentada, e a expressão de A2aR foi positivamente correlacionada com a fase de GC. Os resultados sugerem que a adenosina activa a via de sinalização PI3K/AKT/mTOR ligando-se a A2aR, o que acaba por promover o progresso da GC. Madak-Erdogan et al. descobriram que os ácidos gordos livres (FFAs) activaram o receptor de estrogénio α (ERα) e as vias mTOR, que foram correlacionadas com uma maior proliferação e invasividade das células ER (+) do cancro da mama.
Estes estudos indicam que a via de sinalização mTOR está intimamente relacionada com o metabolismo tumoral, e fornecem apoio teórico para a aplicação combinada de inibidores mTOR e alguns medicamentos que interferem com o metabolismo tumoral (Fig. 2).
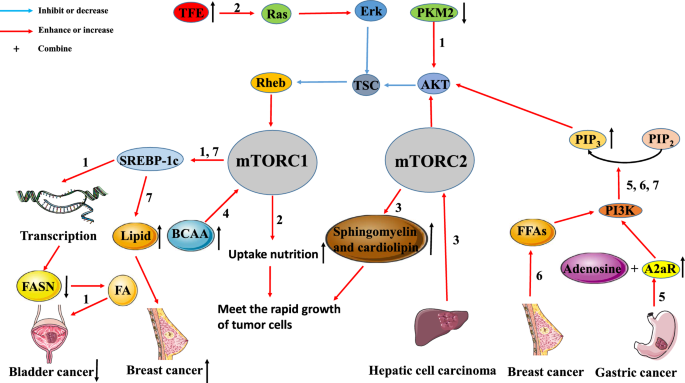
Interacção entre o metabolismo tumoral e a via de sinalização do mTOR. A via de sinalização do mTOR está intimamente relacionada com o metabolismo tumoral. Via 1: No cancro da bexiga, a regulação da expressão PKM2 reduz a expressão SREBP-1 através da via inactivada AKT/TSC/Rehb/mTORC1. A desregulação da SREBP-1c inibe a geração de FA ao inibir a transcrição FASN, levando à inibição do crescimento tumoral). Via 2: A regulação ascendente do TEF nos tumores activa a via Ras/Erk/TSC/Rehb/mTORC1. A activação desta via promoverá a absorção de nutrientes pelas células tumorais para satisfazer as necessidades do rápido crescimento dos tumores. Caminho 3: O HCC pode aumentar a produção de esfingomielina e cardiolipina activando a mTORC2. Grandes quantidades de esfingomielina e cardiolipina são utilizadas para montar membranas celulares, que também satisfazem as necessidades de rápida proliferação tumoral. Via 4: A acumulação de BCAA pode promover a ocorrência e desenvolvimento de tumores através da activação da mTORC1. Via 5: A2aR, que é altamente expressa em cancro gástrico, liga adenosina para activar a via PI3K/AKT/mTORC1. Caminho 6: No cancro da mama, os FFAs promovem a proliferação tumoral e a metástase activando o caminho PI3K/AKT/mTORC1. Caminho 7: O caminho PI3K/AKT/mTORC1/SREBP promove a proliferação do cancro da mama induzindo nova síntese lipídica
Células imunes
Tumores podem desenvolver tolerância imunitária ao suprimir a capacidade do sistema imunitário de reconhecer e matar células tumorais. A imunoterapia tumoral é um tema de investigação quente nos últimos anos, e uma variedade de evidências mostra que o caminho do mTOR, que é frequentemente activado anormalmente nos tumores, pode regular a diferenciação e função das células imunitárias.
Células T
Células T-progenitoras da medula óssea entram no timo, onde se diferenciam em dois tipos de células: αβ Células T e γδ Células T. Através da experiência de eliminação de genes, Yang et al. provaram que a eliminação de RAPTOR em mTORC1 iria quebrar o processo de remodelação do metabolismo oxidativo e do metabolismo da glucose durante a diferenciação das células T. Isto desencadeia a produção de espécies reactivas de oxigénio (ROS), o que perturba a diferenciação das células T de αβ e aumenta a diferenciação das células T de γδ. Além disso, Essig et al. mostraram que o roquin podia baixar a expressão da via PI3K/mTOR. A desregulamentação da via PI3K/mTOR não só inibe a diferenciação e activação das células T tradicionais, mas também limita a especialização das células Treg. Pollizzi et al. encontraram em modelos de rato que a activação do mTORC1 promoveu a produção de um aglomerado de células T effector 8+ de diferenciação (CD) com alta glicólise. Estas células T retêm o fenótipo effector mas não convertem para um fenótipo de memória. Em contraste, as células T com actividade reduzida de mTORC1 têm as características das células de memória mas não se podem diferenciar em células effector, e não podem produzir uma resposta de memória imunitária devido à função metabólica defeituosa. Outros estudos mostraram que a mTORC1 poderia afectar a função effector das células T CD8+, enquanto a actividade mTORC2 regulou a capacidade de memória das células T CD8+.
Em geral, a via de sinalização da mTOR pode afectar a diferenciação e função das células T. Estes estudos alargam a nossa compreensão actual da biologia das células T.
Células matadoras naturais e células dendríticas
A via de sinalização mTOR não só regula as células T, mas está estreitamente relacionada com a diferenciação e funções das células dendríticas (DCs) e das células matadoras naturais (NK). A DC tem uma forte capacidade de apresentação de antígenos, e as células NK são células imunes importantes no corpo. Wang et al. provaram que o mTORC1 e o mTORC2 regulam os efeitos das células NK de uma forma única. Verificaram que o mTORC2 regula negativamente a função das células NK principalmente através da inibição do transdutor de sinal e activador da transcrição 5 (STAT5)/família portadora 7 membro 5 (SLC7A5) eixo. Enquanto o mTORC1 regula positivamente a actividade do mTORC2 mantendo a via de sinalização da interleucina (IL)-15 mediada pelo CD122. Para além das células NK, acredita-se que a DC também esteja relacionada com a via de sinalização de mTOR nos últimos anos. Chen et al. concluíram que a apoptose de DC derivada de células mononucleares da medula óssea (BMM) foi reduzida após tratamento com inibidores de mTOR. Também descobriram que as DC derivadas de células BMM tinham melhores capacidades de apresentação antigénica e que os linfócitos CD8+ T citotóxicos específicos do e7 activados por estas DC tinham maior actividade anti-tumor. Portanto, os inibidores de mTOR podem aumentar a eficácia da imunoterapia tumoral, prolongando a vida útil da DC, melhorando a apresentação de antigénio e a capacidade de processamento de antigénio. Estes estudos fornecem ideias para visar células NK e DC para terapia antitumoral.
Macrófagos
Macrófagos tipo M1 podem matar células tumorais de múltiplas formas, enquanto os macrófagos tipo M2 promovem a ocorrência, invasão, e metástase dos tumores. Zhihua et al. relataram que a expressão de microRNA (miRNA)-30c foi significativamente reduzida em GC. Outros estudos mostraram que o factor induzível de hipoxia-1α (HIF-1α) inibiu a expressão do miRNA-30c. A desregulação do miRNA-30c irá reduzir a actividade de mTOR e glicólise em macrófagos relacionados com tumores. Isto irá eventualmente promover o crescimento de GC e metástase, inibindo a diferenciação e função dos macrófagos tipo M1.
Em geral, a via mTOR, que é frequentemente activada nos tumores, promove o crescimento tumoral através da regulação da diferenciação e função das células imunitárias. Isto desempenhará um papel positivo na exploração de nova imunoterapia e na melhoria do tratamento tumoral.
Resistência a medicamentos tumoral
A forma como tratamos vários cancros, mas os tumores desenvolvem inevitavelmente resistência a medicamentos. Quando o tumor se torna resistente, os efeitos secundários do tratamento aumentam enquanto a eficácia do medicamento diminui significativamente.
Os tumores do sistema digestivo
Estudos demonstraram que a proteína desacoplamento mitocondrial 2 (UCP2) leva à resistência do tumor a múltiplos medicamentos anticancerígenos, reduzindo as ROS geradas pelo metabolismo mitocondrial. Dando et al. provaram que a combinação de genipina e everolimus poderia inibir sinergicamente o crescimento de células adenocarcinoma pancreático (PAAD) e induzir a autofagia das células tumorais. Isto porque a inibição da UCP2 em células PADD activa a via Akt/mTOR por um mecanismo dependente de ROS, o que reduz o efeito anti-proliferação da genipina inibidora da UCP2. A via do porco-espinho mediada pela proteína GLI1 do dedo de zinco desempenha um papel importante na GC. No entanto, Yao et al. demonstraram que a via AKT/mTOR pode activar a GLI1. Além disso, as expressões GLI1 e p-AKT foram correlacionadas com metástases celulares tumorais e resistência aos medicamentos, e o nível de expressão foi negativamente correlacionado com o prognóstico dos pacientes com GC.
Tumores respiratórios
O inibidor AZD1775 da wee1, que visa a reparação do ADN e pontos de verificação do ciclo celular, demonstrou ser eficaz em alguns pacientes com cancro do pulmão, mas a resistência aos medicamentos também é comum . A este respeito, Sen et al. descobriram que a expressão do receptor AXL tirosina quinase (ARK) no cancro do pulmão de pequenas células resistentes ao AZD1775 (SCLC) foi aumentada. ARK pode directamente ou através de mTOR activar a via extracelular das proteínas reguladas (ERK) para recrutar e activar o ponto de controlo kinase 1 (CHK1). Estes resultados sugerem que a ARK pode melhorar a reparação de danos no DNA activando o CHK1, o que acaba por invalidar o inibidor Wee1. Da mesma forma, Ye et al. demonstraram que no cancro do pulmão de células não pequenas (NSCLC), a transmembrane-4 L-six familiar-1 (TM4SF1) regula a sensibilidade do tumor aos medicamentos de quimioterapia regulando a expressão do receptor de domínio discóide 1 (DDR1)/Akt/ERK/mTOR via.
Câncer de rim e cancro da pele
Inibidores da tirosina quinase (TKI) podem ser utilizados para tratar o carcinoma de células renais (RCC), mas alguns pacientes com RCC desenvolverão resistência aos medicamentos . Ishibashi et al. relataram que o tratamento combinado do inibidor de interleucina-6 receptor (IL-6R) e do inibidor de TKI de dose baixa foi mais eficaz na inibição do crescimento e angiogénese do RCC in vivo em comparação com o uso exclusivo do inibidor de TKI. Isto porque doses baixas de inibidores de TKI induzem níveis elevados de IL-6, o que activa a via AKT/mTOR. Estes resultados sugerem que o mecanismo de falha dos inibidores de TKI em alguns pacientes de RCC está relacionado com uma elevada activação de IL-6 da via de sinalização mTOR.
B-Raf proto-oncogene (BRAF) mutações ocorrem no cancro de pele não-melanoma (NMSC), mas os inibidores de BRAF não têm sido utilizados em tais tumores. A principal razão é que o BRAF mutado NMSC tem resistência primária ou secundária aos inibidores de BRAF. Sen et al. encontraram uma forte correlação entre a via de sinalização PI3K/mTOR e a resistência aos inibidores de BRAF. Isto sugere que a activação da via de sinalização mTOR pode levar à resistência NMSC com mutação de BRAF aos inibidores de BRAF. Além disso, Obenauf et al. descobriram que os inibidores de BRAF, receptor anaplástico tirosina quinase (ALK) e receptor epidérmico do factor de crescimento (EGFR) induziram alguns sinais de secreção nas células cancerosas, o que levou à proliferação e metástase de células tumorais resistentes a drogas. Outros estudos descobriram que em células melanoma tratadas com inibidor de BRAF, a desregulação do factor de transcrição FOS relacionado com o antigénio-1 (FRA1) activa múltiplas vias de sinalização, entre as quais a via PI3K/AKT/mTOR desempenha um papel importante. Quando as vias de sinalização BRAF e PI3K/AKT/mTOR são simultaneamente inibidas, o crescimento de células de melanoma humano com mutação BRAF resistente a medicamentos pode ser inibido.
Os estudos acima mencionados sugerem que as células tumorais podem escapar à morte celular induzida por medicamentos anti-tumor, activando a via de sinalização intracelular mTOR, pelo que a activação da via de sinalização mTOR pode ser um dos mecanismos de resistência aos medicamentos nos tumores. Combinações de fármacos visando a via de sinalização mTOR podem ser utilizadas para tratar tumores que tenham desenvolvido resistência.
Autofagia e apoptose do cancro
Por um lado, a autofagia pode manter o genoma estável através da remoção de organelas danificadas e proteínas desdobradas, de modo a inibir o crescimento de células cancerosas . Por outro lado, a autofagia fornece ao tumor mais nutrientes, o que reforça a capacidade do tumor de lidar com ambientes extremos . Além disso, a proliferação ilimitada de tumores deve-se em parte à inibição da apoptose das células tumorais.
Sun et al. concluíram que o mTOR inibe a expressão do glicogénio sintetase kinase-3 (GSK-3) nas células cancerosas da próstata. A desregulação do GSK-3 inibirá a via de sinalização da caspase-3, levando à redução da produção de ROS. A diminuição da ROS inibe a apoptose das células tumorais para proteger as células cancerosas da próstata. Contudo, Zou et al. relataram que o mTORC2 impediu a ligação do inibidor canceroso da proteína fosfatase 2A (CIP2A) à proteína fosfatase 2A (PP2A) para restaurar a actividade da PP2A. PP2A reduz a transcrição de miR-9-3p e upregula a expressão do factor de transcrição E2F 1 (E2F1) promovendo a degradação de c-Myc, inibindo assim a apoptose das células tumorais. Além disso, Yang et al. relataram que a expressão de p-AKT, p-mTOR, P62 e linfoma de células B (BCL-2) foi significativamente diminuída no carcinoma espinocelular oral (OSCC) de células com longa não codificação de RNA (lncRNA) CASC9 knockdown, enquanto a expressão de BCL2 associada ao X (BAX) foi aumentada. Estes resultados sugerem que o lncRNA CASC9 inibe a apoptose autophagy-mediated através da via AKT/mTOR, que promove a proliferação de células OSCC.
Em resumo, os estudos acima indicados indicam que a via de sinalização mTOR pode promover a ocorrência e progressão de tumores regulando a autofagia e a apoptose de células tumorais. Além disso, a investigação acima referida também fornece apoio teórico à investigação clínica sobre medicamentos anti-cancerígenos, o que é de grande importância.