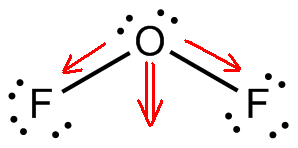
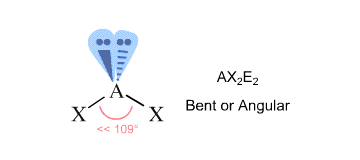O difluoreto de oxigénio, #”OF”_2#, é uma molécula polar porque tem uma geometria molecular dobrada.
Esta geometria molecular assegura que os momentos dipolo associados às ligações oxigénio – fluoreto não se anulam mutuamente para produzir uma molécula não polar.
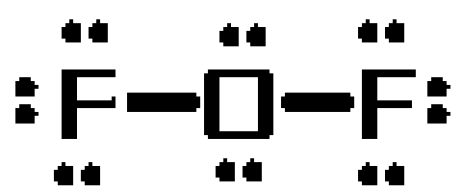
Para ver porque é que isto acontece, desenhar a estrutura da molécula Lewis. A molécula terá um total de #20# electrões de valência
ul>
#6# do átomo de oxigénio #7# de cada um dos dois átomos de flúor
O átomo de oxigénio assumirá o papel de átomo central, formando ligações únicas com os dois átomos de flúor. Estas ligações serão responsáveis por #4# dos electrões de valência #20# da molécula.
Os electrões #16# resultantes serão colocados como pares solitários
ul>
três pares solitários em cada átomo de flúor dois pares solitários no átomo de oxigénio
p>Agora, é muito importante perceber que as estruturas de Lewis não se destinam a transmitir geometria molecular!
A fim de encontrar a geometria da molécula, contam-se as regiões de densidade de electrões que rodeiam o átomo central – estas dar-lhe-ão o número estéreo do átomo.
Regiões de densidade de electrões são ligações a outros átomos (aqui ligações simples, duplas, ou triplas contam como uma região) e pares solitários de electrões.
No seu caso, o átomo central de oxigénio está ligado a dois outros átomos e está rodeado por dois pares solitários #-># tem um número estéreo igual a #4#.
Segundo a Teoria VSEPR, isto corresponde a uma geometria molecular #”AX”_2 “E”_2#, que é característica de uma molécula dobrada.
Agora, a diferença de electronegatividade entre flúor e oxigénio assegura que as duas ligações #”O”-“F “# são polares. A geometria molecular dobrada fará com que os dois momentos dipolares se adicionem um ao outro.
O resultado será a formação de um momento dipolo permanente, e assim uma molécula polar