A tabela periódica é uma disposição tabular dos elementos químicos, ordenados por número atómico, configurações electrónicas, e propriedades químicas recorrentes. Esta ordem mostra tendências periódicas, tais como elementos com comportamento semelhante na mesma coluna. Em geral, dentro de uma linha (período) os elementos são metais à esquerda, e não metais à direita.
A tabela periódica é um dos símbolos mais emblemáticos da ciência, resume muito do conhecimento da química. Em qualquer das suas versões, está presente em salas de aula e laboratórios em todo o mundo. Nenhuma outra disciplina tem um documento semelhante.
O sistema periódico, desenvolvido na segunda metade do século XIX, proporcionou uma disposição sistemática dos elementos em grupos naturais. O alcance desta disposição permitiu prever com considerável certeza as propriedades de alguns elementos desconhecidos e os compostos prováveis que estes formaram. Os desenvolvimentos posteriores forneceram a base teórica para a Tabela Periódica de hoje. O grande número de elementos conhecidos e substâncias sintetizadas criou uma necessidade urgente de os classificar.
Um pouco de História Sobre a Tabela Periódica
No início de 1812 o químico alemão John W. Döbereiner tentou uma primeira aproximação, organizando os elementos descobertos em grupos de três. Esta classificação implicava agrupá-los por ordem crescente de acordo com a sua massa atómica.
Em 1860 o francês Alexandre Béguyer (geólogo francês) verificou uma certa periodicidade nos elementos, comparando as suas dimensões e propriedades físicas. Nos seus estudos verificou uma sequência lógica entre as magnitudes e propriedades observadas nos átomos e as suas respectivas dimensões e abundâncias.
Em 1864, Julius Lothar Meyer publicou a primeira versão da tabela periódica e mais tarde o químico russo Dmitri Ivanovich Mendeleev enunciou e publicou a Lei Periódica e a Tabela Periódica dos Elementos Químicos.
 p>Dmitri Ivanovich Mendeleev
p>Dmitri Ivanovich Mendeleev A capacidade de previsão de Mendeleev foi brilhante; Não só enunciou a lei da periodicidade química, como também ordenou que os elementos encontrados e guardou espaço para aqueles que ainda não tinham sido descobertos, prevendo mesmo as suas propriedades físicas e químicas.
A Tabela Periódica Hoje
O comportamento dos átomos é determinado pela sua configuração electrónica, com a distribuição dos electrões no nível mais externo a determinar a sua reactividade e natureza química. Por esta razão, os elementos que possuem uma distribuição electrónica semelhante exibirão propriedades químicas semelhantes.
As propriedades dos átomos repetem-se periodicamente se os elementos químicos forem ordenados de acordo com o seu número atómico crescente (Z).
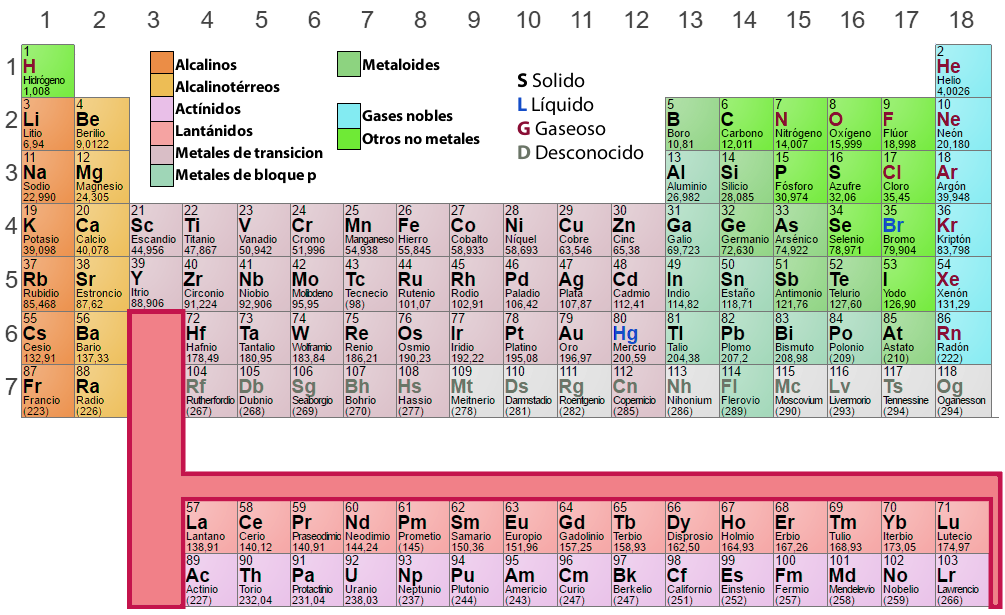
Análise da Tabela Periódica
Na tabela periódica, os elementos que têm um padrão semelhante de configuração electrónica na concha exterior estão dispostos nas mesmas colunas (Grupos ou Famílias). Os elementos que têm níveis de energia idênticos estão dispostos nas mesmas filas (Períodos).
Grupos ou Famílias
Esta é uma ordenação vertical dos elementos da tabela periódica, de acordo com propriedades químicas semelhantes. A numeração tradicional das dezoito colunas é I A, II A, III A, IV A, etc., como vemos no quadro periódico acima. Actualmente, a IUPAC (União Internacional de Química Pura e Aplicada) recomenda numerações sucessivas, ou seja: 1, 2, 3, 4, 5, etc. É importante considerar o seguinte:
- Hidrogénio (H), embora aparecendo no grupo IA (1), não é um metal alcalino. Pelo contrário, o hidrogénio
é tão diferente dos outros elementos químicos que algumas classificações preferem colocá-lo fora da
tabela. - Outra separação importante que podemos fazer na tabela periódica é aquela em que dividimos os elementos em metais, não metálicos, e gases nobres.
li>Grupos A são os mais importantes da tabela, os seus elementos são chamados representativos.li>Elementos nos grupos III B, IV B, V B, VI B, VII B, VIII B, I B e II B constituem os chamados elementos de transição
elementos. Note-se que o grupo VIII B é um grupo triplo.
Os elementos do mesmo grupo possuem propriedades químicas semelhantes e caracterizam-se por terem um número igual de electrões no último nível de energia. Cada elemento de um grupo é colocado em períodos diferentes e para os designar é anotado com números romanos (I, II, III, IV, etc.) o número de electrões no último nível, seguido de uma letra (A ou B) que identifica a sua natureza e os tipos de orbitais que apresenta.
Períodos
As sete linhas ou filas horizontais que aparecem na tabela periódica são chamadas períodos, é importante notar que:
- No sexto período, a terceira grelha contém 15 elementos (do lantânio ao lutécio) que, por conveniência, são indicados numa linha abaixo da tabela; começando pelo lantânio, esses elementos formam a chamada série lanthanide.
- Analogicamente, no sétimo período, a terceira grelha também contém 15 elementos químicos (actínio através do laurentium), que são indicados na segunda linha abaixo da tabela. A começar pelo actínio, eles formam a série actinídea.
li>De notar que todos os elementos depois do urânio (U-92) não existem na natureza, tendo de ser sintetizados artificialmente. São chamados elementos transuranicos. Para além destes elementos, tecnécio (Tc-43), promécio (Pm-61) e astatino (As-85) são também artificialmente sintetizados.
Elementos do mesmo período têm o mesmo número de níveis de energia com electrões. Os períodos são numerados tendo em conta o valor do nível energético ultraperiférico. Cada período começa com um metal alcalino e termina com um gás nobre, excepto no primeiro nível, onde o Hidrogénio está localizado.
h2>Elementos no Sistema Periódico
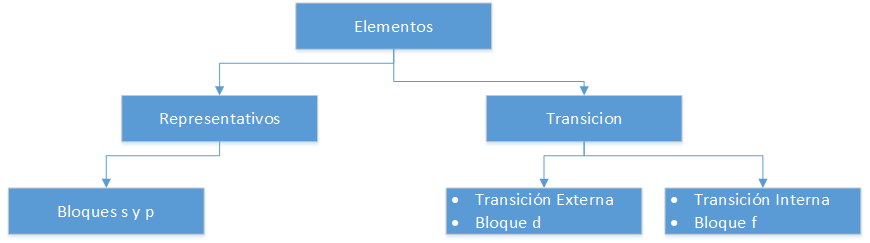
Elementos Representativos
Correspondem aos grupos A da tabela periódica. Não cumprem a regra do octeto, ou seja, o seu último nível de energia é inferior a 8 electrões. Assim, por exemplo, os átomos dos elementos representativos pertencentes ao grupo III A, como o Alumínio (Al), têm 3 electrões de valência na sua última concha, ou seja, têm orbitais p incompletos (p1 a p6).
Os elementos dos grupos IA a VA, têm tendência a desistir dos electrões para atingir a configuração de gás nobre mais próxima (ns2 np6). Em contraste, elementos dos grupos VI A e VII A, capturam electrões para alcançar a configuração de gás nobre mais próxima.
| Grupo | Nome | Configuração Electrónica |
|---|---|---|
| IA | Alcalina | ns1 |
| IIA | A. | ns2np2 |
| VA | Nitrogénico | ns2np3 |
| VIA | Calcogénico | ns2np4 |
| Calcogénico | ns2np4 | |
| VIIA | Halogens | ns2np5 |
| 0 | Gases nobres | ns2np6 |
Elementos de transição externa
São colocados nos grupos B do sistema periódico. Os elementos pertencentes a esta classificação têm d orbitais (d1 a d10) no seu último nível energético.
Elementos de transição interna
Estão localizados na parte inferior da tabela periódica, são também chamados de terras raras. A sua principal característica é que têm f orbitais (f1 a f14) no seu último nível energético.
Natureza dos Elementos
Gases Nobres
- Coluna 18 na tabela periódica.
- Grupo VIII ou 0.
- Caracterizam-se por terem todos os seus níveis electrónicos completos.
- Configuração electrónica do tipo ns2p6, ns2 (Hélio).
- Em condições normais são quimicamente inertes (muito pouco reactivos).
elementos metálicos
- São quase todos sólidos (à temperatura ambiente), com excepção de Mercúrio, Césio e Rubídio.
- perdem facilmente electrões, tornando-se catiões estáveis.
- têm um brilho metálico e são muito bons condutores de calor.
- São dúcteis, o que significa que sob a acção de uma força podem ser deformados sem se partirem.
- São maleáveis, ou seja, a sua capacidade de deformar permite que sejam utilizados para fazer folhas.
são muito bons condutores de corrente eléctrica.