- >li>Diga a teoria atómica moderna.li>Aprenda como os átomos são construídos.
A peça mais pequena de um elemento que mantém a identidade desse elemento é chamada de átomo. Os átomos individuais são extremamente pequenos. Seria necessário cerca de cinquenta milhões de átomos seguidos para fazer uma linha de 1 cm de comprimento. O período no final de uma frase impressa tem vários milhões de átomos. Os átomos são tão pequenos que é difícil acreditar que toda a matéria é feita de átomos – mas é.
O conceito de que os átomos desempenham um papel fundamental na química é formalizado pela teoria atómica moderna, declarada pela primeira vez por John Dalton, um cientista inglês, em 1808. Consiste em três partes:
- Toda a matéria é composta de átomos.
- Os átomos do mesmo elemento são os mesmos; átomos de elementos diferentes são diferentes.
- Os átomos combinam-se em rácios de números inteiros para formar compostos.
Estes conceitos formam a base da química.
Embora a palavra átomo venha de uma palavra grega que significa “indivisível”, compreendemos agora que os próprios átomos são compostos por partes mais pequenas chamadas partículas subatómicas. A primeira parte a ser descoberta foi o electrão, uma minúscula partícula subatómica com uma carga negativa. É muitas vezes representado como e-, com o sobrescrito certo mostrando a carga negativa. Mais tarde, foram descobertas duas partículas maiores. O próton é uma partícula subatómica mais maciça (mas ainda minúscula) com uma carga positiva, representada como p+. O neutron é uma partícula subatómica com aproximadamente a mesma massa que um protão, mas sem carga. É representado ou como n ou n0. Sabemos agora que todos os átomos de todos os elementos são compostos por electrões, prótons, e (com uma excepção) neutrões. A tabela 3.1 “Propriedades das Três Partículas Subatómicas” resume as propriedades destas três partículas subatómicas.
Tabela 3.1 Propriedades das Três Partículas Subatómicas
| Nome | Símbolo | Charge | |
|---|---|---|---|
| Proton | p+ | 1.6 × 10-27 | 1+ |
| Neutron | n, n0 | 1,6 × 10-27 | |
| e- | 9.1 × 10-31 | 1- |
Como é que estas partículas estão dispostas em átomos? Elas não estão dispostas ao acaso. Experiências de Ernest Rutherford na Inglaterra nos anos 1910s apontaram para um modelo nuclear do átomo. Os prótons e neutrões relativamente maciços são recolhidos no centro de um átomo, numa região chamada núcleo do átomo (núcleos do plural). Os electrões estão fora do núcleo e passam o seu tempo a orbitar no espaço em torno do núcleo. (Ver Figura 3.1 “A Estrutura do Átomo”.)
Figure 3.1 The Structure of the Atom
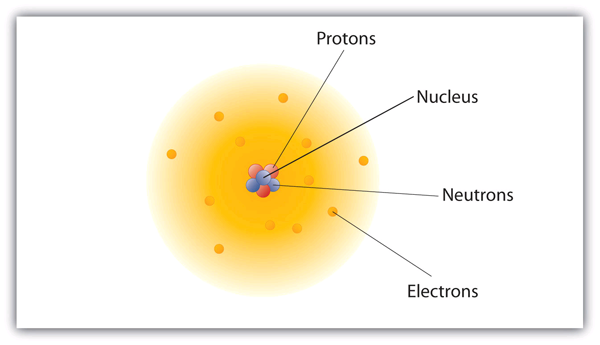
Atoms have protons and neutrons in the center, making the nucleus, while the electrons orbit the nucleus.
A teoria atómica moderna afirma que os átomos de um elemento são os mesmos, enquanto que os átomos de elementos diferentes são diferentes. O que torna diferentes os átomos de diferentes elementos? A característica fundamental que todos os átomos de um mesmo elemento partilham é o número de prótons. Todos os átomos de hidrogénio têm um e apenas um próton no núcleo; todos os átomos de ferro têm 26 prótons no núcleo. Este número de prótons é tão importante para a identidade de um átomo que é chamado o número atómico do elemento. Assim, o hidrogénio tem um número atómico de 1, enquanto que o ferro tem um número atómico de 26. Cada elemento tem o seu próprio número atómico característico.
Os átomos do mesmo elemento podem ter números diferentes de neutrões, contudo. Os átomos do mesmo elemento (ou seja, átomos com o mesmo número de prótons) com números diferentes de nêutrons são chamados isótopos. A maioria dos elementos que ocorrem naturalmente existem como isótopos. Por exemplo, a maioria dos átomos de hidrogénio tem um único protão no seu núcleo. Contudo, um pequeno número (cerca de um num milhão) de átomos de hidrogénio tem um próton e um nêutron nos seus núcleos. Este isótopo particular de hidrogénio é chamado deutério. Uma forma muito rara de hidrogénio tem um protão e dois neutrões no seu núcleo; este isótopo de hidrogénio chama-se trítio. A soma do número de prótons e neutrões no núcleo chama-se o número de massa do isótopo.
Atomos neutros têm o mesmo número de electrões que têm prótons, pelo que a sua carga global é zero. Contudo, como veremos mais adiante, este nem sempre será o caso.
Exemplo 1
- Os átomos de carbono mais comuns têm seis prótons e seis nêutrons nos seus núcleos. Quais são o número atómico e o número de massa destes átomos de carbono?
- Um isótopo de urânio tem um número atómico de 92 e um número de massa de 235. Qual é o número de protões e neutrões no núcleo deste átomo?
Solução
- Se um átomo de carbono tiver seis protões no seu núcleo, o seu número atómico é 6. Se também tiver seis neutrões no núcleo, então o número de massa é 6 + 6, ou 12.
- Se o número atómico de urânio for 92, então esse é o número de protões no núcleo. Porque o número de massa é 235, então o número de neutrões no núcleo é 235 – 92, ou 143.
Test Yourself
O número de prótons no núcleo de um átomo de estanho é 50, enquanto que o número de neutrões no núcleo é 68. Quais são o número atómico e o número de massa deste isótopo?
Resposta
Número atómico = 50, número de massa = 118
Quando nos referimos a um átomo, usamos simplesmente o nome do elemento: o termo sódio refere-se tanto ao elemento como a um átomo de sódio. Mas pode ser difícil usar o nome dos elementos o tempo todo. Em vez disso, a química define um símbolo para cada elemento. O símbolo atómico é uma abreviatura de uma ou duas letras do nome do elemento. Por convenção, a primeira letra do símbolo de um elemento é sempre maiúscula, enquanto que a segunda letra (se presente) é minúscula. Assim, o símbolo para hidrogénio é H, o símbolo para sódio é Na, e o símbolo para níquel é Ni. A maioria dos símbolos provém do nome inglês do elemento, embora alguns símbolos provenham do nome latino de um elemento. (O símbolo para o sódio, Na, vem do seu nome latino, natrium.) A tabela 3.2 “Nomes e Símbolos de Elementos Comuns” lista alguns elementos comuns e os seus símbolos. Deve memorizar os símbolos no Quadro 3.2 “Nomes e Símbolos de Elementos Comuns”, pois é assim que vamos representar os elementos através da química.
Tabela 3.2 Nomes e Símbolos de Elementos Comuns
Nome do ElementoSímbolo
| Element Nome | ||||
|---|---|---|---|---|
| Alumínio | Al | Mercúrio | Hg | |
| Argon | Ar | Molibdénio | Mo | |
| Arsénico | As | Neon | Ne | |
| Bário | Ba | Níquel | Ni | |
| Beryllium | Be | N | ||
| Bismuto | Bi | Oxygen | O | |
| B | B | Paládio | Pd | |
| Bromine | Br | Phosphorus | P | |
| Ca | Platina | Pt | ||
| Carbono | C | Potássio | K | |
| Cl | Rádio | Ra | ||
| Cr | Radon | Rn | ||
| Cobalto | Co | Rubidium | Rb | Cobre | Cu | Scandium | Sc>/td> |
| Fluorine | F | Selenium | Se | Gálio | Ga | Silicone | Si |
| Germanium | Ge | Prata | Ag | Gold | Au | Sódio | Na |
| Helium | He | Sr | H | Sulfur | S |
| Iodo | I | Tantalum | Ta | |
| Iridium | Ir | Tin | Sn | |
| Iron | Fe | Titanium | Ti | |
| Krypton | Kr | Tungsten | W | |
| Lead | Pb | Uranium | U | |
| Lithium | Li | Xenon | Xe | |
| Magnésio | Mg | Zinco | Zn | |
| Mn | Zircónio | Zr |
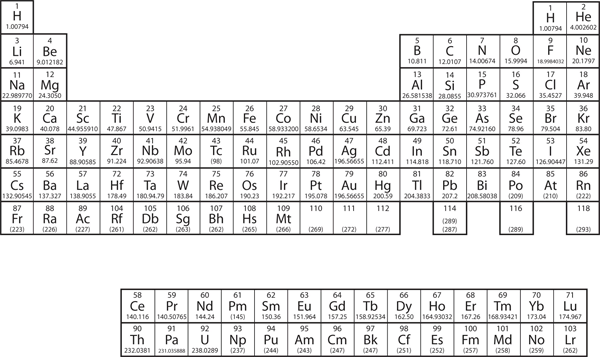
Os elementos estão agrupados numa tabela especial chamada tabela periódica. Uma tabela periódica simples é mostrada na Figura 3.2 “Uma tabela periódica simples”, enquanto uma tabela mais extensa é apresentada no Capítulo 17 “Apêndice”: Tabela Periódica dos Elementos”. Os elementos da tabela periódica são listados por ordem de número atómico ascendente. A tabela periódica tem uma forma especial que se tornará importante para nós quando considerarmos a organização dos electrões em átomos (ver Capítulo 8 “Estrutura Electrónica”). Uma utilização imediata da tabela periódica ajuda-nos a identificar metais e não-metálicos. Os não metais estão no canto superior direito da tabela periódica, num dos lados da linha pesada que divide a parte direita da tabela. Todos os outros elementos são metais.
Figure 3.2 A Simple Periodic Table
Existe uma forma fácil de representar isótopos utilizando os símbolos atómicos. Usamos a construção
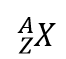
onde X é o símbolo do elemento, A é o número da massa, e Z é o número atómico. Assim, para o isótopo de carbono que tem 6 prótons e 6 neutrões, o símbolo é
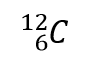
onde C é o símbolo do elemento, 6 representa o número atómico, e 12 representa o número de massa.
Exemplo 2
- Qual é o símbolo de um isótopo de urânio que tem um número atómico de 92 e um número de massa de 235?
- Quantos prótons e neutrões estão em 26Fe?
Solução
- O símbolo para este isótopo é
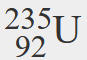
- Este átomo de ferro tem 26 prótons e 56 – 26 = 30 neutrões.
Test Yourself
Quantos protões estão em 11N?
Resposta
11 protões
É também comum indicar o número de massa após o nome de um elemento para indicar um determinado isótopo. Carbon-12 representa um isótopo de carbono com 6 protões e 6 neutrões, enquanto o urânio-238 é um isótopo de urânio que tem 146 neutrões.
Key Takeaways
- A química é baseada na moderna teoria atómica, que afirma que toda a matéria é composta por átomos.
- Os próprios átomos são compostos por prótons, neutrões e electrões.
- Cada elemento tem o seu próprio número atómico, que é igual ao número de protões no seu núcleo.
- Isótopos de um elemento contêm números diferentes de neutrões.
- Elementos são representados por um símbolo atómico.
- A tabela periódica é um gráfico que organiza todos os elementos.
Exercícios
Lista as três afirmações que compõem a teoria atómica moderna.
Explicar como os átomos são compostos.
Qual é o número atómico de hélio?
Qual é a diferença entre deutério e trítio?
a) ![]()
b) 26F e 25M
c) 14S e 15P
14. Que par representa isótopos?
a) 20C e 19K
b) 26F e 26F
c) 92U e 92U
15. Dar símbolos completos de cada átomo, incluindo o número atómico e o número de massa.
a) um átomo de oxigénio com 8 prótons e 8 neutrões
b) um átomo de potássio com 19 prótons e 20 neutrões
c) um átomo de lítio com 3 prótons e 4 neutrões
16. Dar símbolos completos de cada átomo, incluindo o número atómico e o número de massa.
a) um átomo de magnésio com 12 protões e 12 neutrões
b) um átomo de magnésio com 12 protões e 13 neutrões
c) um átomo de xénon com 54 protões e 77 neutrões
17. Americium-241 é um isótopo utilizado em detectores de fumo. Qual é o símbolo completo para este isótopo?
18. Carbon-14 é um isótopo utilizado para realizar testes de datação radioactiva em material anteriormente vivo. Qual é o símbolo completo para este isótopo?
19. Dar símbolos atómicos para cada elemento.
a) sódio
b) argon
c) azoto
d) rádon
20. Dar símbolos atómicos para cada elemento.
a) prata
b) ouro
c) mercúrio
d) iodo
21. Dê o nome do elemento.
a) Si
b) Mn
c) Fe
d) Cr
22. Dê o nome do elemento.
a) F
b) Cl
c) Br
d) I
Respostas
Toda a matéria é composta por átomos; átomos do mesmo elemento são iguais, e átomos de elementos diferentes são diferentes; átomos combinam em proporções de números inteiros para formar compostos.
Um próton é maior que um electrão.
proton: 1+; electrão: 1-; neutão: 0

O número atómico é o número de prótons de um núcleo. O boro tem um número atómico de cinco.
Isótopos são átomos do mesmo elemento, mas com números diferentes de neutrões. 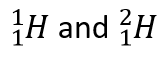 são exemplos.
são exemplos.
a) isótopos
b) não isótopos
c) não isótopos
a) ![]()
b) 19K
c) ![]()
95A
a) Na
b) Ar
c) N
d) Rn
a) silício
b) manganês
c) ferro
d) crómio