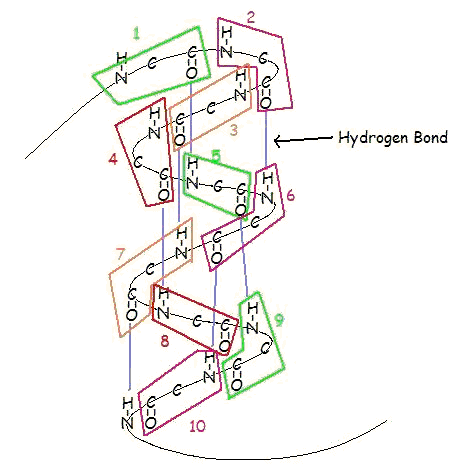
An α-helix é uma bobina direita de resíduos de aminoácidos numa cadeia de polipeptídeos, tipicamente variando entre 4 e 40 resíduos. Esta bobina é mantida unida por ligações de hidrogénio entre o oxigénio de C=O na bobina superior e o hidrogénio de N-H na bobina inferior. Tal ligação de hidrogénio é formada exactamente a cada 4 resíduos de aminoácidos, e cada volta completa da hélice é apenas 3,6 resíduos de aminoácidos. Este padrão regular dá à hélice α características muito definidas no que diz respeito à espessura da bobina e ao comprimento de cada volta completa ao longo do eixo da hélice.
A integridade estrutural de uma hélice α-helix depende em parte da configuração estereoscópica correcta. Aminoácidos cujo grupo R é demasiado grande (triptofano, tirosina) ou demasiado pequeno (glicina) desestabilizam α-helices. A prolina também desestabiliza α-helices devido à sua geometria irregular; o seu grupo R liga-se de novo ao azoto do grupo amida, o que causa obstrução estérica. Além disso, a falta de hidrogénio no nitrogénio do Proline impede-o de participar na ligação de hidrogénio.
Outro factor que afecta α-helix stability is the total dipole moment of the entire helix due to individual dipoles of the C=O groups involved in hydrogen bonding. O estável α-helices normalmente termina com um aminoácido carregado para neutralizar o momento dipolo.