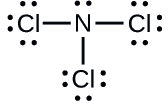Calcolo delle cariche formali
La carica formale di un atomo in una molecola è la carica ipotetica che l’atomo avrebbe se potessimo ridistribuire gli elettroni nei legami in modo uniforme tra gli atomi. Un altro modo per dire questo è che la carica formale risulta quando prendiamo il numero di elettroni di valenza di un atomo neutro, sottraiamo gli elettroni non leganti, e poi sottraiamo il numero di legami collegati a quell’atomo nella struttura di Lewis.
Così, calcoliamo la carica formale come segue:
Carica formale = (elettroni di valenza dell’elemento “libero”) – (elettroni non condivisi) – (legami).
Possiamo ricontrollare i calcoli della carica formale determinando la somma delle cariche formali per tutta la struttura. La somma delle cariche formali di tutti gli atomi in una molecola deve essere zero; la somma delle cariche formali in uno ione deve essere uguale alla carica dello ione.
Dobbiamo ricordare che la carica formale calcolata per un atomo non è la carica effettiva dell’atomo nella molecola. La carica formale è solo un’utile procedura contabile; non indica la presenza di cariche reali.
Calcolo della carica formale dalle strutture di Lewis
Assegnare le cariche formali ad ogni atomo nello ione interalogeno \(\ce{ICl4-}}.
Soluzione
Dividiamo equamente le coppie di elettroni di legame per tutti i legami \(\ce{I-Cl})
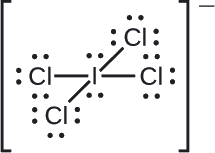
Assegniamo coppie di elettroni solitari ai loro atomi. Ogni atomo di Cl ha ora sette elettroni assegnati, e l’atomo di I ne ha otto.
Sottraiamo questo numero dal numero di elettroni di valenza dell’atomo neutro:
- I: 7 – 8 = -1
- Cl: 7 – 7 = 0
La somma delle cariche formali di tutti gli atomi è uguale a -1, che è identica alla carica dello ione (-1).
Esercizio \(\PageIndex{1})
Calcolare la carica formale per ogni atomo della molecola di monossido di carbonio:

Risposta
C -1, O +1
Calcolo della carica formale dalle strutture di Lewis
Assegnare le cariche formali ad ogni atomo della molecola interalogena \(\ce{BrCl3}\).
Soluzione
Assegnate uno degli elettroni in ogni legame Br-Cl all’atomo di Br e uno all’atomo di Cl in quel legame:
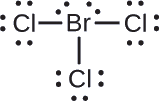
Assegnate le coppie solitarie ai loro atomi. Ora ogni atomo di Cl ha sette elettroni e l’atomo di Br ha sette elettroni.
Sottrai questo numero dal numero di elettroni di valenza per l’atomo neutro. Questo dà la carica formale:
- Br: 7 – 7 = 0
- Cl: 7 – 7 = 0
Tutti gli atomi in \(\ce{BrCl3}\ hanno una carica formale pari a zero, e la somma delle cariche formali è pari a zero, come deve essere in una molecola neutra.
Esercizio \(\PageIndex{2})
Determina la carica formale per ogni atomo in \(\ce{NCl3}).
Risposta
N: 0; tutti e tre gli atomi di Cl: 0