La tavola periodica è una disposizione tabellare degli elementi chimici, ordinati per numero atomico, configurazioni elettroniche e proprietà chimiche ricorrenti. Questo ordine mostra le tendenze periodiche, come gli elementi con un comportamento simile nella stessa colonna. In generale, all’interno di una riga (periodo) gli elementi sono metalli a sinistra, e non metalli a destra.
La tavola periodica è uno dei simboli più emblematici della scienza, riassume gran parte delle conoscenze della chimica. In qualsiasi delle sue versioni è presente nelle aule e nei laboratori di tutto il mondo. Nessun’altra disciplina ha un documento simile.
Il sistema periodico, sviluppato nella seconda metà del XIX secolo, ha fornito una disposizione sistematica degli elementi in gruppi naturali. La portata di questa disposizione ha permesso di prevedere con notevole certezza le proprietà di alcuni elementi sconosciuti e i probabili composti che formavano. Gli sviluppi successivi hanno fornito la base teorica per l’odierna Tavola Periodica. Il gran numero di elementi conosciuti e di sostanze sintetizzate creò un bisogno urgente di classificarli.
Un po’ di storia della tavola periodica
All’inizio del 1812 il chimico tedesco John W. Döbereiner tentò una prima approssimazione organizzando gli elementi scoperti in gruppi di tre. Questa classificazione consisteva nel raggrupparli in ordine crescente secondo la loro massa atomica.
Nel 1860 il francese Alexandre Béguyer (un geologo francese) verificò una certa periodicità degli elementi confrontando le loro dimensioni e proprietà fisiche. Nei suoi studi verificò una sequenza logica tra le grandezze e le proprietà osservate negli atomi e le loro rispettive dimensioni e abbondanze.
Nel 1864, Julius Lothar Meyer pubblicò la prima versione della tavola periodica e più tardi il chimico russo Dmitri Ivanovich Mendeleev enunciò e pubblicò la Legge Periodica e La tavola periodica degli elementi chimici.

Dmitri Ivanovich Mendeleev
La capacità di previsione di Mendeleev era brillante; non solo enunciò la legge della periodicità chimica, ma ordinò anche gli elementi trovati e lasciò spazio a quelli che non erano ancora stati scoperti, prevedendo anche le loro proprietà fisiche e chimiche.
La tavola periodica oggi
Il comportamento degli atomi è determinato dalla loro configurazione elettronica, con la distribuzione degli elettroni nel livello più esterno che determina la loro reattività e natura chimica. Per questo motivo, gli elementi che possiedono una distribuzione elettronica simile esibiranno proprietà chimiche simili.
Le proprietà degli atomi si ripetono periodicamente se gli elementi chimici sono ordinati secondo il loro numero atomico crescente (Z).
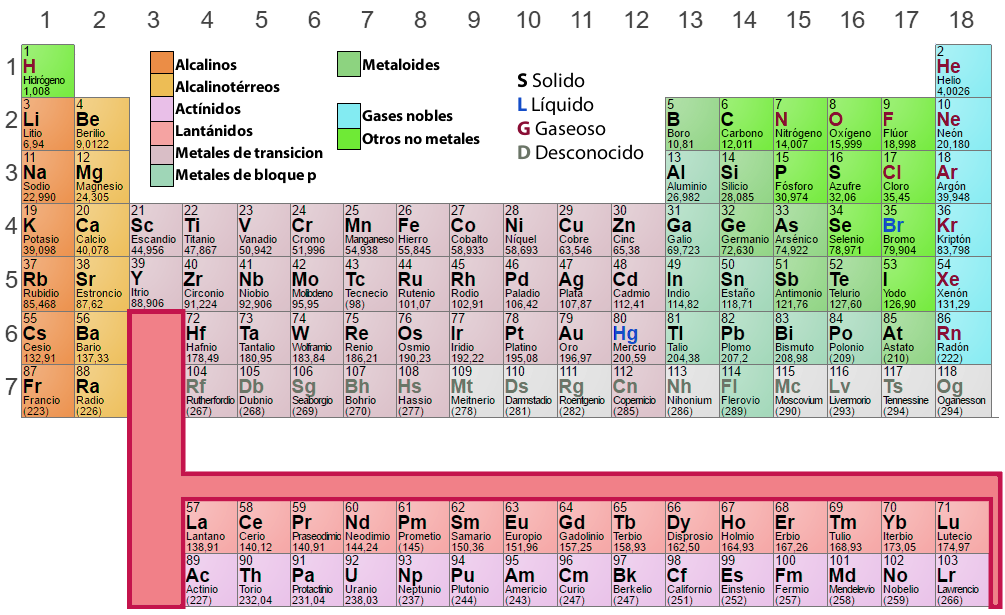
Analisi della tavola periodica
Nella tavola periodica, gli elementi che hanno un modello simile di configurazione elettronica nel guscio esterno sono disposti nelle stesse colonne (Gruppi o Famiglie). Gli elementi che hanno livelli energetici identici sono disposti nelle stesse righe (periodi).
Gruppi o famiglie
Questo è un ordine verticale degli elementi nella tavola periodica, secondo proprietà chimiche simili. La numerazione tradizionale delle diciotto colonne è I A, II A, III A, IV A, ecc. Oggi, la IUPAC (Unione Internazionale di Chimica Pura e Applicata) raccomanda una numerazione successiva, cioè: 1, 2, 3, 4, 5, ecc. È importante considerare quanto segue:
- L’idrogeno (H), anche se appare nel gruppo IA (1), non è un metallo alcalino. Al contrario, l’idrogeno
è così diverso dagli altri elementi chimici che alcune classificazioni preferiscono metterlo fuori dalla
tabella. - I gruppi A sono i più importanti nella tabella, i loro elementi sono chiamati rappresentativi.
- Gli elementi dei gruppi III B, IV B, V B, VI B, VII B, VIII B, I B e II B costituiscono i cosiddetti
elementi di transizione. Si noti che il gruppo VIII B è un gruppo triplo. - Un’altra importante separazione che possiamo fare nella tavola periodica è quella in cui dividiamo gli
elementi in metalli, non metalli e gas nobili.
Gli elementi dello stesso gruppo possiedono proprietà chimiche simili e sono caratterizzati dall’avere un numero uguale di elettroni nell’ultimo livello energetico. Ogni elemento di un gruppo è collocato in diversi periodi e per designarli si nota con numeri romani (I, II, III, IV, ecc.) il numero di elettroni nell’ultimo livello, seguito da una lettera (A o B) che identifica la sua natura e i tipi di orbitali che presenta.
Periodi
Le sette linee orizzontali o righe che appaiono nella tavola periodica sono chiamate periodi, è importante notare che:
- Nel sesto periodo la terza griglia racchiude 15 elementi (dal lantanio al lutezio) che, per comodità, sono indicati su una linea sotto la tabella; partendo dal lantanio, questi elementi formano la cosiddetta serie dei lantanidi.
- Analogicamente, nel settimo periodo, la terza griglia racchiude anche 15 elementi chimici (dall’attinio al laurenzio), che sono indicati sulla seconda linea sotto la tabella. A partire dall’attinio, formano la serie degli attinidi.
- Si noti che tutti gli elementi dopo l’uranio (U-92) non esistono in natura, dovendo essere sintetizzati artificialmente. Sono chiamati elementi transuranici. Oltre a questi elementi, vengono sintetizzati artificialmente anche il tecnezio (Tc-43), il promezio (Pm-61) e l’astato (As-85).
Gli elementi dello stesso periodo hanno lo stesso numero di livelli energetici con elettroni. I periodi sono numerati considerando il valore del livello energetico più esterno. Ogni periodo inizia con un metallo alcalino e finisce con un gas nobile, eccetto il primo livello, dove si trova l’idrogeno.
Elementi nel sistema periodico
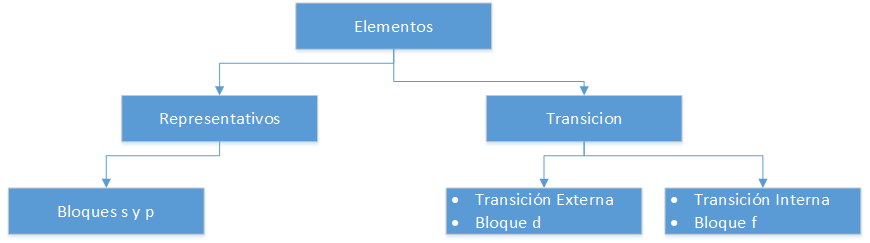
Elementi rappresentativi
Corrispondono ai gruppi A della tavola periodica. Non rispettano la regola dell’ottetto, cioè il loro ultimo livello energetico è inferiore a 8 elettroni. Così, per esempio, gli atomi degli elementi rappresentativi appartenenti al gruppo III A, come l’alluminio (Al), hanno 3 elettroni di valenza nel loro ultimo guscio, cioè, hanno orbitali p incompleti (da p1 a p6).
Gli elementi dei gruppi IA a VA, hanno una tendenza a cedere elettroni per raggiungere la configurazione di gas nobile più vicina (ns2 np6). Al contrario, gli elementi dei gruppi VI A e VII A, catturano elettroni per raggiungere la configurazione di gas nobile più vicina.
| Gruppo | Nome | Configurazione elettronica | |
|---|---|---|---|
| IA | Alkaline | ns1 | |
| IIA | A. | ns2np2 | |
| VA | Nitrogenous | ns2np3 | |
| VIA | Calcogenic | ns2np4 | |
| VIA | Calcogenic | ns2np4 | |
| VIIA | Alogeni | ns2np5 | |
| 0 | Gas nobili | ns2np6 |
Elementi di transizione esterni
Sono collocati nei gruppi B del sistema periodico. Gli elementi appartenenti a questa classificazione hanno orbitali d (da d1 a d10) nel loro ultimo livello energetico.
Elementi di transizione interni
Si trovano nella parte bassa della tavola periodica, sono anche chiamati terre rare. La loro caratteristica principale è che hanno orbitali f (da f1 a f14) nel loro ultimo livello energetico.
Natura degli elementi
Gas nobili
- Colonna 18 della tavola periodica.
- Gruppo VIII o 0.
- Sono caratterizzati dall’avere tutti i loro livelli elettronici completi.
- Configurazione elettronica di tipo ns2p6, ns2 (Elio).
- In condizioni normali sono chimicamente inerti (molto poco reattivi).
Elementi metallici
- Sono quasi tutti solidi (a temperatura ambiente), ad eccezione di Mercurio, Cesio e Rubidio.
- Sono ottimi conduttori di corrente elettrica.
- Perdono elettroni facilmente, diventando cationi stabili.
- Hanno una lucentezza metallica e sono ottimi conduttori di calore.
- Sono duttili, il che significa che sotto l’azione di una forza possono essere deformati senza rompersi.
- Sono malleabili, cioè la loro capacità di deformarsi permette di usarli per fare fogli.