- State la moderna teoria atomica.
- Impara come sono costruiti gli atomi.
Il più piccolo pezzo di un elemento che mantiene l’identità di quell’elemento è chiamato atomo. I singoli atomi sono estremamente piccoli. Ci vorrebbero circa cinquanta milioni di atomi in fila per fare una linea lunga 1 cm. Il punto alla fine di una frase stampata contiene diversi milioni di atomi. Gli atomi sono così piccoli che è difficile credere che tutta la materia sia fatta di atomi, ma è così.
Il concetto che gli atomi hanno un ruolo fondamentale nella chimica è formalizzato dalla moderna teoria atomica, enunciata per la prima volta da John Dalton, uno scienziato inglese, nel 1808. Essa consiste di tre parti:
- Tutta la materia è composta da atomi.
- Gli atomi dello stesso elemento sono uguali; gli atomi di elementi diversi sono diversi.
- Gli atomi si combinano in rapporti numerici interi per formare i composti.
Questi concetti formano la base della chimica.
Anche se la parola atomo deriva da una parola greca che significa “indivisibile”, ora sappiamo che gli atomi stessi sono composti da parti più piccole chiamate particelle subatomiche. La prima parte ad essere scoperta fu l’elettrone, una piccola particella subatomica con una carica negativa. Viene spesso rappresentato come e-, con l’apice a destra che indica la carica negativa. Più tardi, furono scoperte due particelle più grandi. Il protone è una particella subatomica più massiccia (ma ancora minuscola) con una carica positiva, rappresentata come p+. Il neutrone è una particella subatomica con circa la stessa massa del protone ma senza carica. È rappresentato come n o n0. Ora sappiamo che tutti gli atomi di tutti gli elementi sono composti da elettroni, protoni e (con un’eccezione) neutroni. La tabella 3.1 “Proprietà delle tre particelle subatomiche” riassume le proprietà di queste tre particelle subatomiche.
Tabella 3.1 Proprietà delle tre particelle subatomiche
| Nome | Simbolo | Massa (ca.; kg) | Carica | |
|---|---|---|---|---|
| Protone | p+ | 1.6 × 10-27 | 1+ | |
| Neutrone | n, n0 | 1.6 × 10-27 | nessuno | |
| Elettrone | e- | 9.1 × 10-31 | 1- |
Come sono disposte queste particelle negli atomi? Non sono disposte a caso. Gli esperimenti condotti da Ernest Rutherford in Inghilterra nel 1910 hanno indicato un modello nucleare dell’atomo. I protoni e i neutroni relativamente massicci sono raccolti nel centro di un atomo, in una regione chiamata nucleo dell’atomo (nucleo plurale). Gli elettroni sono fuori dal nucleo e passano il loro tempo orbitando nello spazio intorno al nucleo. (Vedi Figura 3.1 “La struttura dell’atomo”.)
Figura 3.1 La struttura dell’atomo
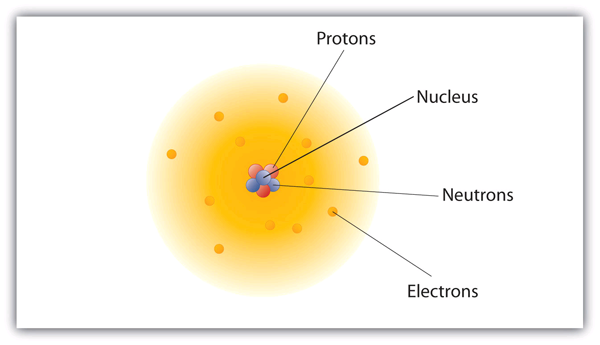
Gli atomi hanno protoni e neutroni al centro, che costituiscono il nucleo, mentre gli elettroni orbitano attorno al nucleo.
La moderna teoria atomica afferma che gli atomi di un elemento sono uguali, mentre gli atomi di elementi diversi sono diversi. Cosa rende diversi gli atomi di elementi diversi? La caratteristica fondamentale che tutti gli atomi di uno stesso elemento condividono è il numero di protoni. Tutti gli atomi di idrogeno hanno uno e un solo protone nel nucleo; tutti gli atomi di ferro hanno 26 protoni nel nucleo. Questo numero di protoni è così importante per l’identità di un atomo che viene chiamato numero atomico dell’elemento. Così, l’idrogeno ha un numero atomico di 1, mentre il ferro ha un numero atomico di 26. Ogni elemento ha il suo numero atomico caratteristico.
Gli atomi dello stesso elemento possono però avere un numero diverso di neutroni. Gli atomi dello stesso elemento (cioè gli atomi con lo stesso numero di protoni) con un diverso numero di neutroni sono chiamati isotopi. La maggior parte degli elementi presenti in natura esistono come isotopi. Per esempio, la maggior parte degli atomi di idrogeno hanno un solo protone nel loro nucleo. Tuttavia, un piccolo numero (circa uno su un milione) di atomi di idrogeno ha un protone e un neutrone nel suo nucleo. Questo particolare isotopo dell’idrogeno è chiamato deuterio. Una forma molto rara di idrogeno ha un protone e due neutroni nel nucleo; questo isotopo di idrogeno è chiamato trizio. La somma del numero di protoni e neutroni nel nucleo è chiamata numero di massa dell’isotopo.
Gli atomi neutri hanno lo stesso numero di elettroni che hanno i protoni, quindi la loro carica complessiva è zero. Tuttavia, come vedremo più avanti, non sarà sempre così.
Esempio 1
- Gli atomi di carbonio più comuni hanno sei protoni e sei neutroni nel loro nucleo. Quali sono il numero atomico e il numero di massa di questi atomi di carbonio?
- Un isotopo di uranio ha un numero atomico di 92 e un numero di massa di 235. Qual è il numero di protoni e neutroni nel nucleo di questo atomo?
Soluzione
- Se un atomo di carbonio ha sei protoni nel suo nucleo, il suo numero atomico è 6. Se ha anche sei neutroni nel nucleo, allora il numero di massa è 6 + 6, cioè 12.
- Se il numero atomico dell’uranio è 92, allora questo è il numero di protoni nel nucleo. Poiché il numero di massa è 235, allora il numero di neutroni nel nucleo è 235 – 92, cioè 143.
Test Yourself
Il numero di protoni nel nucleo di un atomo di stagno è 50, mentre il numero di neutroni nel nucleo è 68. Quali sono il numero atomico e il numero di massa di questo isotopo?
Risposta
Numero atomico = 50, numero di massa = 118
Quando ci si riferisce ad un atomo, si usa semplicemente il nome dell’elemento: il termine sodio si riferisce sia all’elemento che ad un atomo di sodio. Ma può essere scomodo usare sempre il nome degli elementi. Invece, la chimica definisce un simbolo per ogni elemento. Il simbolo atomico è un’abbreviazione di una o due lettere del nome dell’elemento. Per convenzione, la prima lettera del simbolo di un elemento è sempre maiuscola, mentre la seconda lettera (se presente) è minuscola. Così, il simbolo dell’idrogeno è H, il simbolo del sodio è Na, e il simbolo del nichel è Ni. La maggior parte dei simboli deriva dal nome inglese dell’elemento, anche se alcuni simboli derivano dal nome latino di un elemento. (Il simbolo del sodio, Na, deriva dal suo nome latino, natrium.) La tabella 3.2 “Nomi e simboli degli elementi comuni” elenca alcuni elementi comuni e i loro simboli. Dovresti memorizzare i simboli della Tabella 3.2 “Nomi e simboli degli elementi comuni”, perché è così che rappresenteremo gli elementi in tutta la chimica.
Tabella 3.2 Nomi e simboli degli elementi comuni
Elemento NomeSimbolo
| Elemento Nome | Simbolo | |||
|---|---|---|---|---|
| Alluminio | Al | Mercurio | Hg | |
| Argon | Ar | Molibdeno | Mo | |
| Arsenico | As | Neon | Ne | |
| Bario | Ba | Nichel | Ni | |
| Beryllium | Be | Nitrogeno | N | |
| Bismuto | Bi | Ossigeno | O | |
| Boron | B | Palladio | Pd | |
| Bromo | Br | Fosforo | P | |
| Calcio | Ca | Platino | Pt | |
| Carbonio | C | Potassio | K | |
| Cloro | Cl | Radium | Ra | |
| Cromo | Cr | Radon | Rn | |
| Cobalto | Co | Rubidio | Rb | |
| Rame | Cu | Scandio | Sc | |
| Fluoro | F | Selenio | Se | |
| Gallio | Ga | Silicio | Si | |
| Germanio | Ge | Argento | Ag | |
| Oro | Au | Sodio | Na | |
| Elio | He | Stronzio | Sr | |
| Idrogeno | H | Zolfo | S | |
| Iodio | I | Tantalio | Ta | |
| Iridio | Ir | Stagno | Sn | |
| Ferro | Fe | Titanio | Ti | |
| Krypton | Kr | Tungsteno | W | |
| Piombo | Pb | Uranio | U | |
| Litio | Li | Xenon | Xe | |
| Magnesio | Mg | Zinco | Zn | |
| Manganese | Mn | Zirconio | Zr |
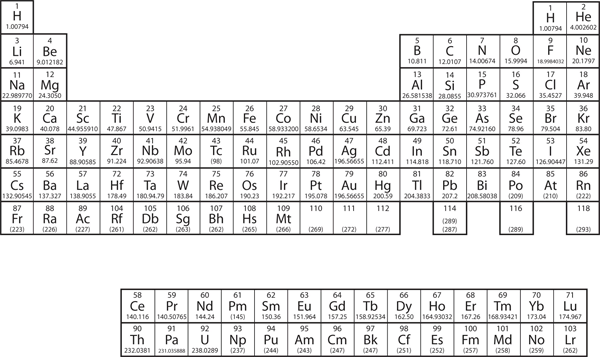
Gli elementi sono raggruppati in una tabella speciale chiamata tavola periodica. Una semplice tavola periodica è mostrata nella Figura 3.2 “Una semplice tavola periodica”, mentre una più estesa è presentata nel Capitolo 17 “Appendice: Tavola periodica degli elementi”. Gli elementi della tavola periodica sono elencati in ordine crescente di numero atomico. La tavola periodica ha una forma speciale che diventerà importante per noi quando considereremo l’organizzazione degli elettroni negli atomi (vedi Capitolo 8 “Struttura elettronica”). Un uso immediato della tavola periodica ci aiuta a identificare metalli e non metalli. I non metalli sono nell’angolo in alto a destra della tavola periodica, su un lato della linea pesante che divide la parte destra del grafico. Tutti gli altri elementi sono metalli.
Figura 3.2 Una semplice tavola periodica
C’è un modo semplice per rappresentare gli isotopi usando i simboli atomici. Usiamo la costruzione
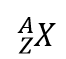
dove X è il simbolo dell’elemento, A è il numero di massa e Z è il numero atomico. Così, per l’isotopo del carbonio che ha 6 protoni e 6 neutroni, il simbolo è
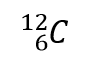
dove C è il simbolo dell’elemento, 6 rappresenta il numero atomico e 12 il numero di massa.
Esempio 2
- Qual è il simbolo di un isotopo dell’uranio che ha un numero atomico di 92 e un numero di massa di 235?
- Quanti protoni e neutroni ci sono in 26Fe?
Soluzione
- Il simbolo di questo isotopo è
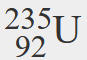
- Questo atomo di ferro ha 26 protoni e 56 – 26 = 30 neutroni.
Test Yourself
Quanti protoni ci sono in 11N?
Risposta
11 protoni
È anche comune indicare il numero di massa dopo il nome di un elemento per indicare un particolare isotopo. Il carbonio-12 rappresenta un isotopo del carbonio con 6 protoni e 6 neutroni, mentre l’uranio-238 è un isotopo dell’uranio che ha 146 neutroni.
Punti chiave
- La chimica si basa sulla moderna teoria atomica, che afferma che tutta la materia è composta da atomi.
- Gli atomi stessi sono composti da protoni, neutroni ed elettroni.
- Ogni elemento ha il suo numero atomico, che è uguale al numero di protoni nel suo nucleo.
- Gli isotopi di un elemento contengono un numero diverso di neutroni.
- Gli elementi sono rappresentati da un simbolo atomico.
- La tavola periodica è una tabella che organizza tutti gli elementi.
Esercizi
Elenco le tre affermazioni che costituiscono la moderna teoria atomica.
Spiega come sono composti gli atomi.
Qual è più grande, un protone o un elettrone?
Qual è più grande, un neutrone o un elettrone?
Quali sono le cariche di ciascuna delle tre particelle subatomiche?
Dove si trova la maggior parte della massa di un atomo?
Segnala il diagramma di un atomo di boro, che ha cinque protoni e sei neutroni nel suo nucleo.
Segnala un diagramma di un atomo di elio, che ha due protoni e due neutroni nel suo nucleo.
Definire il numero atomico. Qual è il numero atomico di un atomo di boro?
Qual è il numero atomico dell’elio?
Definire l’isotopo e fare un esempio.
Qual è la differenza tra deuterio e trizio?
Quale coppia rappresenta gli isotopi?
a) ![]()
b) 26F e 25M
c) 14S e 15P
14. Quale coppia rappresenta gli isotopi?
a) 20C e 19K
b) 26F e 26F
c) 92U e 92U
15. Dai i simboli completi di ogni atomo, includendo il numero atomico e il numero di massa.
a) un atomo di ossigeno con 8 protoni e 8 neutroni
b) un atomo di potassio con 19 protoni e 20 neutroni
c) un atomo di litio con 3 protoni e 4 neutroni
16. Dai i simboli completi di ogni atomo, includendo il numero atomico e il numero di massa.
a) un atomo di magnesio con 12 protoni e 12 neutroni
b) un atomo di magnesio con 12 protoni e 13 neutroni
c) un atomo di xeno con 54 protoni e 77 neutroni
17. L’americio-241 è un isotopo usato nei rivelatori di fumo. Qual è il simbolo completo di questo isotopo?
18. Il carbonio-14 è un isotopo usato per eseguire test di datazione radioattiva su materiale precedentemente vissuto. Qual è il simbolo completo di questo isotopo?
19. Dai i simboli atomici per ogni elemento.
a) sodio
b) argon
c) azoto
d) radon
20. Dai i simboli atomici per ogni elemento.
a) argento
b) oro
c) mercurio
d) iodio
21. Dare il nome dell’elemento.
a) Si
b) Mn
c) Fe
d) Cr
22. Dica il nome dell’elemento.
a) F
b) Cl
c) Br
d) I
Risposte
Tutta la materia è composta da atomi; gli atomi dello stesso elemento sono uguali e gli atomi di elementi diversi sono diversi; gli atomi si combinano in rapporti numerici interi per formare composti.
Un protone è più grande di un elettrone.
protone: 1+; elettrone: 1-; neutrone: 0

Il numero atomico è il numero di protoni in un nucleo. Il boro ha un numero atomico di cinque.
Gli isotopi sono atomi dello stesso elemento ma con un numero diverso di neutroni. 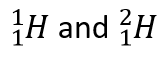 sono esempi.
sono esempi.
a) isotopi
b) non isotopi
c) non isotopi
a) ![]()
b) 19K
c) ![]()
95A
a) Na
b) Ar
c) N
d) Rn
a) silicio
b) manganese
c) ferro
d) cromo