
Definition
Wenn zwei verschiedene Metalle oder Legierungen in eine korrosive Lösung getaucht oder regelmäßig durch Feuchtigkeit verbunden werden, entwickelt jedes ein Korrosionspotential. Wenn die Bedingungen für galvanische Korrosion vorliegen, wird das edlere Metall zur Kathode und das aktivere Metall zur Anode. Zwischen der Anode und der Kathode kann ein messbarer Strom fließen. In diesem Fall wird die Korrosionsrate der Anode in der Betriebsumgebung erhöht, während die Korrosionsrate der Kathode abnimmt.
Die erhöhte Korrosion der Anode wird als „galvanische Korrosion“ bezeichnet.
Galvanische Korrosion wird manchmal genutzt, um die Lebensdauer von Materialien zu verlängern (z. B. Zinkbeschichtungen auf Kohlenstoffstahl und Zinkanoden in Warmwasserbereitern), aber wenn sie nicht berücksichtigt wird und die richtigen Bedingungen vorliegen, kann sie zu unerwarteten Ausfällen führen.
Voraussetzungen für galvanische Korrosion:
Damit galvanische Korrosion auftreten kann, sind drei Elemente erforderlich.
- Zwei Metalle mit unterschiedlichen Korrosionspotentialen
- Direkter elektrischer Kontakt von Metall zu Metall
- Eine leitfähige Elektrolytlösung (z.B. Wasser) muss die beiden Metalle regelmäßig verbinden. Die Elektrolytlösung schafft einen „leitenden Pfad“. Dies kann durch regelmäßiges Eintauchen, Kondenswasser, Regen, Nebel oder andere Feuchtigkeitsquellen geschehen, die die beiden Metalle befeuchten und verbinden.
Fehlt eines dieser Elemente, kann keine galvanische Korrosion auftreten. Wenn z. B. der direkte Kontakt zwischen den beiden Metallen verhindert wird (Kunststoffscheibe, Lackfilm usw.) oder eine andere Unterbrechung des Leitweges vorliegt, kann es keine galvanische Korrosion geben und jedes Metall wird mit seiner normalen Rate in dieser Betriebsumgebung korrodieren. Abbildung 1 zeigt Beispiele für Bedingungen, die nicht alle Voraussetzungen für galvanische Korrosion erfüllen.
Abbildung 1
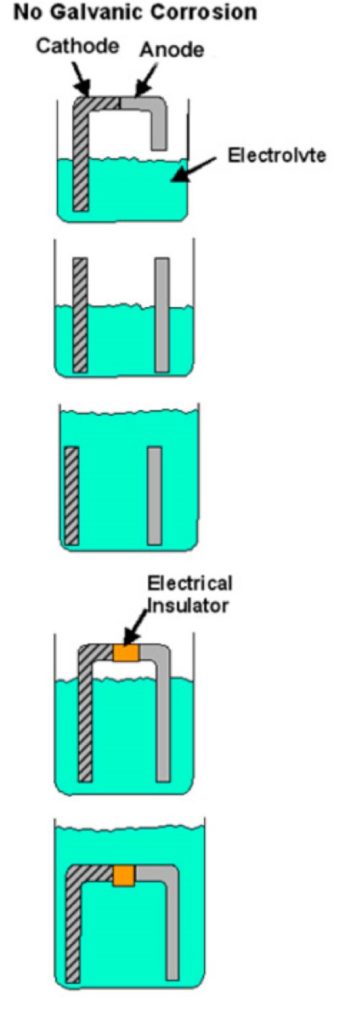
Beispiele für Bimetall-Kombinationen, bei denen galvanische Korrosion nicht auftreten kann
Wenn zwei verschiedene Metalle in der Atmosphäre oder im Wasser miteinander gekoppelt sind, kann die Wahrscheinlichkeit der Entwicklung von galvanischer Korrosion mithilfe einer „galvanischen Reihe“ vorhergesagt werden.“ Bei speziellen Anwendungen, z. B. wenn ungleiche Metalle in Beton eingebettet werden, sollten Korrosionsdaten für diese spezielle Umgebung verwendet werden.
Abbildung 2
Abbildung 2 zeigt die in Meerwasser gemessene galvanische Reihe für einige gängige Metalle und Legierungen. Je weiter zwei Metalle in der Reihe voneinander entfernt sind (z. B. eine größere Differenz zwischen den beiden Zahlen), desto größer ist die treibende Kraft für die galvanische Korrosion. Die anodischsten (aktiven) Metalle stehen oben und die kathodischsten (edlen) unten. Für die nichtrostenden Stähle sind sowohl massive als auch hohle Balken dargestellt. Die hohlen Balken stellen aktiv korrodierenden rostfreien Stahl dar, der ein anderes Potenzial als passiver (nicht korrodierender) rostfreier Stahl hat. Bei den meisten Anwendungen, bei denen ungleiche Metalle kombiniert werden, sollte der passive (massive) Balken verwendet werden, um die Position des Edelstahls zu bestimmen.
Wenn zum Beispiel Zink (man denke an verzinkten Stahl), das ein aktives Material ist und in der Nähe des oberen Endes der Liste liegt, und Edelstahl, ein Edelmetall und in der Nähe des unteren Endes der Liste, in direktem Kontakt und in Gegenwart eines Elektrolyts (Wasser) stehen, wird galvanische Korrosion auftreten, wenn sie regelmäßig einem Elektrolyt ausgesetzt sind.
