
Définition
Lorsque deux métaux ou alliages différents sont immergés dans une solution corrosive ou régulièrement reliés par l’humidité, chacun développe un potentiel de corrosion. Si les conditions de la corrosion galvanique sont réunies, le métal le plus noble devient la cathode et le métal le plus actif devient l’anode. Un courant mesurable peut circuler entre l’anode et la cathode. Si cela se produit, la vitesse de corrosion de l’anode dans l’environnement de service augmentera tandis que la vitesse de corrosion de la cathode diminuera. L’augmentation de la corrosion de l’anode est appelée « corrosion galvanique ». »
La corrosion galvanique est parfois utilisée pour prolonger la durée de vie des matériaux (c’est-à-dire les revêtements de zinc sur l’acier au carbone et les anodes de zinc dans les chauffe-eau), mais, si elle n’est pas prise en compte et que les bonnes conditions existent, elle peut entraîner des défaillances inattendues.
Conditions requises pour la corrosion galvanique :
Pour que la corrosion galvanique se produise, trois éléments sont nécessaires.
- Deux métaux avec des potentiels de corrosion différents
- Contact électrique direct de métal à métal
- Une solution électrolyte conductrice (par exemple de l’eau) doit relier les deux métaux de façon régulière. La solution électrolyte crée un » chemin conducteur « . Cela peut se produire en cas d’immersion régulière, de condensation, de pluie, d’exposition au brouillard ou d’autres sources d’humidité qui humidifient et connectent les deux métaux.
Si l’un de ces éléments manque, la corrosion galvanique ne peut pas se produire. Si, par exemple, le contact direct entre les deux métaux est empêché (rondelle de plastique, film de peinture, etc.) ou s’il y a une autre interruption du chemin conducteur, il ne peut y avoir de corrosion galvanique et chaque métal se corrodera à son rythme normal dans cet environnement de service. La figure 1 montre des exemples de conditions qui ne répondent pas à toutes les exigences de la corrosion galvanique.
Figure 1
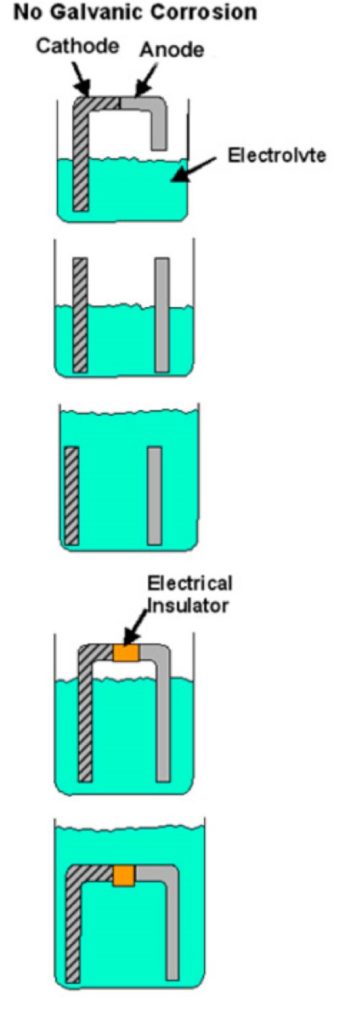
Exemples de combinaisons bimétalliques lorsque la corrosion galvanique ne peut pas se produire
Lorsque deux métaux différents sont couplés dans l’atmosphère ou dans l’eau, la probabilité de développer une corrosion galvanique peut être prédite en utilisant une » série galvanique « . » Dans les applications spécialisées, par exemple lorsque des métaux dissemblables sont noyés dans du béton, il convient d’utiliser les données de corrosion pour cet environnement spécifique.
Figure 2
La figure 2 montre la série galvanique mesurée dans l’eau de mer pour certains métaux et alliages courants. Lorsque deux métaux sont plus éloignés dans la liste (par exemple, une plus grande différence entre les deux chiffres), la force motrice de la corrosion galvanique est accrue. Les métaux les plus anodiques (actifs) se trouvent en haut de la liste et les plus cathodiques (nobles) en bas. Les barres pleines et creuses sont représentées pour les aciers inoxydables. Les barres creuses représentent l’acier inoxydable qui se corrode activement et dont le potentiel est différent de celui de l’acier inoxydable passif (qui ne se corrode pas). Dans la plupart des applications, lorsque des métaux dissemblables sont combinés, la barre passive (pleine) doit être utilisée pour déterminer la position de l’acier inoxydable.
Par exemple, si le zinc (pensez à l’acier galvanisé) qui est un matériau actif et proche du haut de la liste et l’acier inoxydable, un métal noble et proche du bas de la liste étaient en contact direct et en présence d’un électrolyte (eau), une corrosion galvanique se produira s’ils sont régulièrement exposés à un électrolyte.

.