La glicogenolisi, o degradazione del glicogeno, libera il glucosio quando è necessario.
Nel fegato, il glicogeno è una riserva di glucosio per il mantenimento di livelli normali di glucosio nel sangue, e la sua degradazione avviene principalmente:
- in stato di digiuno, ad esempio durante il digiuno notturno;
- tra i pasti;
- durante un’attività fisica ad alta intensità.
Negli epatociti, la glicogenolisi è stimolata dal glucagone e dall’adrenalina, inibita dall’insulina e soggetta a una regolazione allosterica negativa anche da parte del glucosio (vedi sotto).
Nel muscolo, il glicogeno è una fonte di energia per l’attività muscolare; pertanto, la rottura del glicogeno avviene durante la contrazione e solo nei muscoli coinvolti nell’attività.
Nelle cellule muscolari, la glicogenolisi è stimolata dall’adrenalina, e regolata da effettori allosterici positivi e negativi, AMP e ione calcio (Ca2+), e ATP e glucosio 6-fosfato, rispettivamente (vedi sotto).
CONTENUTI
- Fasi della glicogenolisi
- Destino metabolico del glucosio 1-fosfato nel muscolo e nel fegato
- Regolazione covalente della glicogenolisi nel muscolo e nel fegato
- β-Recettori adrenergici
- Proteine G stimolatorie
- Adenil ciclasi
- Proteina chinasi A
- Fosforilasi chinasi
- Regolazione allosterica della glicogenolisi nei muscoli e nel fegato
- Fosforilasi chinasi muscolare
- Fosforilasi epatica fosforilasi chinasi
- Fosforilasi del glicogeno muscolare
- Regolazione allosterica di PP1
- Fosforilasi del glicogeno epatico
Fasi della glicogenolisi
La glicogenolisi inizia con l’azione della glicogeno fosforilasi (EC 2.4.1.1), un omodimero che per la sua attività richiede la presenza di piridossal-5-fosfato, un derivato della piridossina o vitamina B6. L’enzima catalizza la scissione fosforolitica del legame glicosidico α-(1,4), liberando molecole di glucosio una alla volta dalle estremità non riducenti, cioè quelle con un gruppo 4′-OH libero, dei rami esterni. Questa reazione, che non consuma ATP ma un ortofosfato, produce glucosio 1-fosfato.
Glicogeno(n residui di glucosio) + Pi → Glucosio 1-fosfato + Glicogeno(n-1 residui di glucosio)
Nota: nell’intestino tenue, l’α-amilasi pancreatica (EC 3.2.1.1) catalizza la scissione idrolitica dei legami glicosidici α-(1,4) dell’amido, e produce molecole di glucosio.
In vivo, la glicogeno fosforilasi catalizza una fosforolisi irreversibile, una reazione particolarmente vantaggiosa per il muscolo scheletrico e il cuore (vedi sotto). L’irreversibilità della reazione è assicurata dal rapporto /, che di solito è maggiore di 100. Al contrario, la reazione è facilmente reversibile in vitro.
La glicogeno fosforilasi agisce ripetutamente sulle estremità non riducenti dei rami, arrestandosi quando si raggiunge l’unità di glucosio che si trova a 4 residui dal punto di diramazione: questo è il limite esterno del limite della destrina. A questo punto, due attività enzimatiche, presenti sulla stessa catena polipeptidica, completano la scomposizione del glicogeno: l’α-(1,4)-glucano-6-glicosiltransferasi (EC 2.4.1.24) e l’amilo-α-(1,6)-glucosidasi o enzima debranching (EC 3.2.1.33). La prima attività enzimatica trasferisce tre delle rimanenti quattro unità di glucosio dal ramo all’estremità non riducente di un altro ramo, lasciando nella prima catena solo una singola unità di glucosio, che è attaccata alla catena da un legame α-(1,6)-glicosidico. La seconda attività enzimatica idrolizza questo legame α-(1,6)-glicosidico, liberando il glucosio e una catena non ramificata di unità di glucosio legate ad α-(1,4)
Senza il ramo, la glicogeno fosforilasi può continuare a rimuovere unità di glucosio fino a raggiungere il limite successivo della destrina.
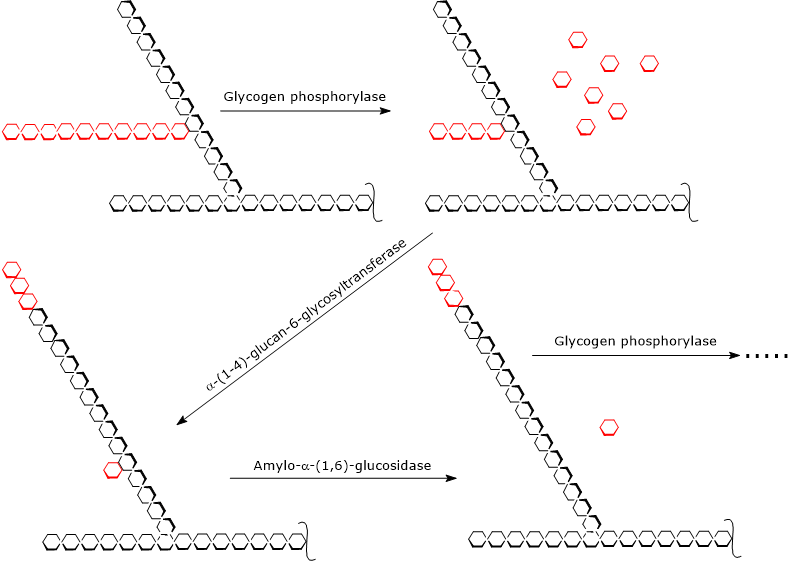
Quindi, i prodotti delle reazioni catalizzate dalle tre attività enzimatiche sono:
- glucosio 1-fosfato (circa il 90% delle molecole di glucosio liberate);
- una piccola quantità di glucosio libero, il restante 10% ;
- una molecola di glicogeno più piccola e meno ramificata.
Fatto metabolico del glucosio 1-fosfato nel muscolo e nel fegato
Il glucosio 1-fosfato è una molecola carica, e quindi è intrappolata all’interno della cellula.
Viene convertito in glucosio 6-fosfato nella reazione catalizzata dalla fosfoglucomutasi (EC 5.4.2.2), lo stesso enzima che interviene anche nella sintesi del glicogeno convertendo il glucosio 6-fosfato in glucosio 1-fosfato. Questo enzima catalizza una reazione reversibile: la direzione è determinata dalle concentrazioni relative delle due molecole, e in questo caso sposta il gruppo fosfato da C1 a C6.
Glucosio 1-fosfato ⇄ Glucosio 6-fosfato
Nel muscolo, e nella maggior parte degli altri organi e tessuti, il glucosio dalla glicogenolisi entra nella glicolisi come glucosio 6-fosfato, bypassando la fase di attivazione catalizzata dall’esochinasi. Pertanto, la glicogeno fosforilasi, rilasciando una molecola di glucosio già “attivata”, risparmia un ATP. Una molecola di ATP è necessaria per sintetizzare un altro intermedio glicolitico, il fruttosio 1,6-bisfosfato.
In questo modo, una parte dell’energia di attivazione richiesta per la sintesi del glicogeno è conservata: la resa netta di ATP per molecola di glucosio dalla glicolisi al lattato è 3 piuttosto che 2, un vantaggio per il muscolo che lavora. L’equazione complessiva è:
Glicogeno(n residui di glucosio) + 3 ADP + 3 Pi → Glicogeno(n-1 residui di glucosio) + 2 Lattato + 3 ATP
Nel fegato, il glucosio 6-fosfato dal glicogeno è defosforilato dalla glucosio 6-fosfatasi (EC 3.1.3.9), e poi rilasciato nel sangue. Queste sono le tappe della rimozione delle unità di glucosio, sotto forma di glucosio fosforilato, da parte della glicogenolisi epatica:
Glicogeno(n residui di glucosio) + Pi → Glucosio 1-Fosfato + Glicogeno(n-1 residui di glucosio)
glucosio-1-fosfato → glucosio-6-fosfato
glucosio-6-fosfato + H2O → glucosio + Pi
L’equazione complessiva è:
Glicogeno(n residui di glucosio) + H2O → Glicogeno(n-1 residui di glucosio) +Glucosio
Regolazione covalente della glicogenolisi nel muscolo e nel fegato
La degradazione del glicogeno è sotto un fine controllo attraverso modifiche covalenti e/o allosteriche di alcune proteine chiave, come la fosforilasi chinasi (EC 2.7.11.19), la glicogeno fosforilasi e la proteina fosfatasi 1.
Qui vengono analizzati gli effetti di due ormoni che agiscono attraverso modifiche covalenti delle proteine bersaglio:
- adrenalina (nota anche come epinefrina), prodotta dalle ghiandole surrenali, che agisce per esempio su muscoli, fegato e cellule adipose;
- glucagone, prodotto dalle cellule alfa del pancreas, che agisce su epatociti e adipociti.
Questi ormoni, legandosi ai loro recettori di membrana, innescano una cascata identica di eventi intracellulari che amplificano di diversi ordini di grandezza il loro segnale, stimolando la glicogenolisi e inibendo la sintesi del glicogeno.
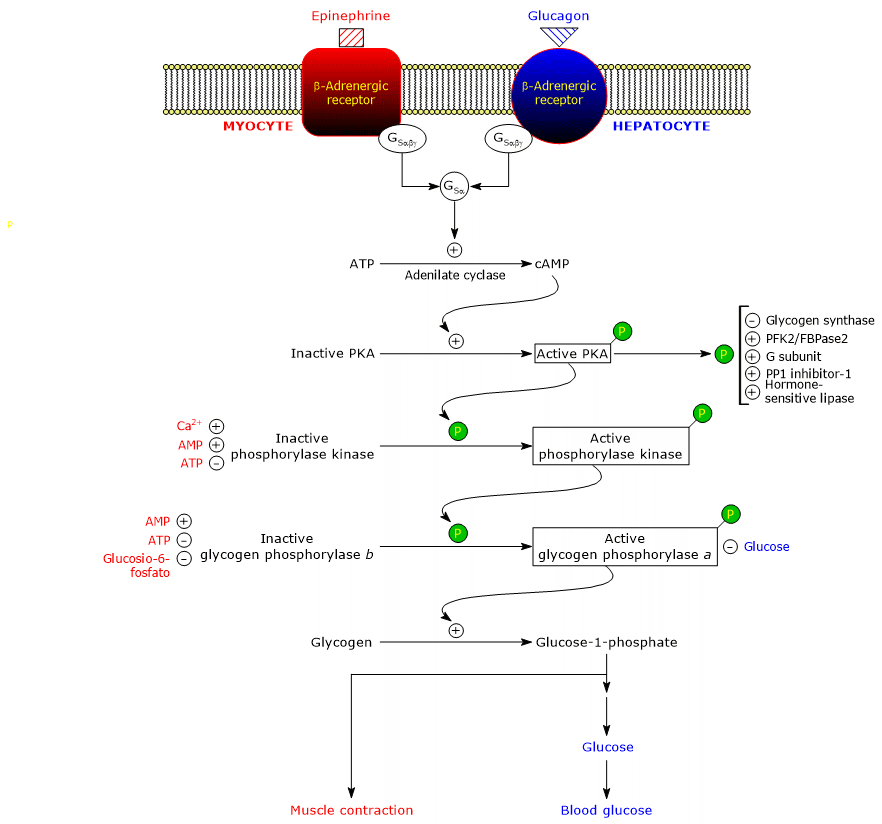
Va notato che anche l’acetilcolina, legandosi al recettore situato alla giunzione neuromuscolare, innesca la stessa cascata di attivazioni di adrenalina e glucagone.
Ecco le proteine coinvolte nella cascata.
recettoriβ-adrenergici
I recettori per l’adrenalina e il glucagone sono proteine integrali di membrana, con sette α-elici transmembrana.
Il termine “adrenergico” deriva da adrenalina. Ci sono quattro sottotipi di recettori adrenergici: α1, α2, β1 e β2. Nella discussione successiva, saranno considerati solo i recettori β1 e β2, indicati come β, e che agiscono nello stesso modo.
I recettoriβ-adrenergici causano cambiamenti nel metabolismo energetico, come:
- un aumento della ripartizione del glicogeno nelle cellule muscolari ed epatiche;
- un aumento della ripartizione dei trigliceridi (lipolisi) nel tessuto adiposo.
Proteine G stimolatorie
Il legame dell’ormone al recettore causa un cambiamento conformazionale nella porzione citosolica del recettore, e questo modifica l’interazione con la seconda proteina della cascata: la proteina legante il nucleotide di guanina stimolatoria o, più semplicemente, la proteina G stimolatoria (GS). Si tratta di un eterotrimero composto da tre subunità: α (contenente il sito di legame del nucleotide), β e γ. Nella forma inattiva, GSαβγ-GDP, l’eterotrimero è accoppiato ai recettori β-adrenergici.
I cambiamenti conformazionali nel recettore permettono di catalizzare la sostituzione di GDP con GTP nella subunità α del complesso GSαβγ. Questo porta alla dissociazione del trimero in un dimero inattivo, βγ, e il complesso GSα-GTP che si muove lungo il piano della superficie interna della membrana plasmatica, alla quale è ancorato da un gruppo palmitoilico legato covalentemente, fino a raggiungere l’adenilciclasi (EC 4.6.1.1.1).
Nota: l’azione della GS assomiglia a quella delle proteine Ras, un’altra classe di proteine G che sono coinvolte nella trasduzione del segnale insulinico.
Adenil ciclasi
È un enzima integrale di membrana, il cui sito attivo è sul lato citosolico della membrana plasmatica. L’interazione tra GSα e adenil ciclasi attiva l’enzima che, a sua volta, catalizza la sintesi di cAMP dall’ATP. Questo porta ad un aumento della concentrazione intracellulare del nucleotide ciclico.
L’attività stimolatoria di GSα è autolimitante, in quanto è una GPTasi, cioè idrolizza il GTP legato a GDP, spegnendosi così. Nella forma inattiva, GSα si dissocia dall’adenil ciclasi e si riassocia con il dimero Gβγ. Pertanto, l’eterotrimero è di nuovo disponibile per interagire con un complesso ormone-recettore.
Proteina chinasi A
cAMP si lega e attiva la protein chinasi cAMP-dipendente o protein chinasi A o PKA (EC 2.7.11.11). La forma inattiva dell’enzima è un tetramero composto da due subunità catalitiche e due subunità regolatrici. Ciascuna delle due subunità regolatrici ha un dominio autoinibitorio, cioè una regione che occupa il sito di legame per il substrato di ciascuna subunità catalitica. Il legame di due molecole di cAMP a due siti su ciascuna subunità regolatoria porta a un cambiamento conformazionale che causa la loro dissociazione dal tetramero, rilasciando le due subunità catalitiche come enzimi attivi. La forma attiva di PKA catalizza la fosforilazione di alcune proteine, attivandole o inibendole, come:
- glicogeno sintasi (EC 2.4.1.11), inibita;
- la lipasi sensibile agli ormoni (EC 3.1.1.79), attivata;
- la fosfofruttochinasi 2/fruttosio-2,6-bisfosfatasi (EC 2.7.1.105 e EC 3.1.3.46 rispettivamente), attivate;
- inibitore-1 e l’unità legante il glicogeno (G) della proteina fosfatasi 1, attivate;
- fosforilasi chinasi, attivata.
cAMP ha un’emivita molto breve: viene idrolizzato ad AMP, che non ha attività di secondo messaggero, nella reazione catalizzata dalla nucleotide ciclico fosfodiesterasi (EC 3.1.4.53). La caffeina e la teofillina, due metilxantine contenute rispettivamente nel caffè e nel tè, inibiscono la fosfodiesterasi, aumentando così l’emivita del cAMP e potenziandone gli effetti.
Fosforilasi chinasi
Il passo successivo della cascata è catalizzato dalla fosforilasi chinasi.
La proteina è costituita da quattro diverse subunità, ciascuna presente con quattro copie per formare un complesso denominato (αβγδ)4. Le subunità γ hanno attività catalitica, mentre α, β e δ sono subunità regolatrici. Le subunità α e β sono fosforilate quando l’enzima passa dallo stato inattivo a quello attivo. La subunità δ, chiamata anche calmodulina, è una proteina regolatrice che lega gli ioni di calcio. Questa proteina è presente anche in un gran numero di altri enzimi. Agisce come un sensore di calcio, cioè risponde ai cambiamenti della concentrazione intracellulare di calcio, influenzando l’attività delle proteine con cui interagisce (vedi sotto). La fosforilasi chinasi esiste in due isoforme, una espressa nel fegato e l’altra nel muscolo scheletrico e cardiaco; differiscono per quanto riguarda le subunità α e γ, che sono codificate da geni diversi.
Una delle proteine bersaglio della fosforilasi chinasi è la glicogeno fosforilasi. Questo enzima esiste come isoenzima in diversi tessuti, e in due stati conformazionali in equilibrio dinamico, indicati come:
- T, per teso o tesa, che è meno attivo;
- R, per rilassato, che è più attivo, e in grado di legarsi al glicogeno, anche nello stato fosforilato (vedi sotto).
La chinasi fosforila un singolo residuo di serina (Ser-14) in ciascuna delle due subunità della glicogeno fosforilasi, che è quasi interamente allo stato T, convertendola nella forma attiva, che, al contrario, è quasi interamente allo stato R, e quindi innescando la scissione del glicogeno.
L’enzima fosforilato è la forma più attiva dell’enzima e viene chiamato glicogeno fosforilasi a; l’enzima non fosforilato è la forma meno attiva dell’enzima e viene chiamato glicogeno fosforilasi b. Le due forme enzimatiche possono essere inibite o attivate allostericamente (vedi sotto).
Nel muscolo, la glicogenolisi rilascia glucosio 1-fosfato che, come visto in precedenza, viene metabolizzato nel muscolo stesso per produrre energia per la contrazione muscolare, e quindi per la risposta di lotta o fuga innescata dall’adrenalina.
Nel fegato, il glucagone attiva il rilascio di glucosio in circolazione per contrastare l’ipoglicemia.
Una volta terminata la situazione di stress, la fosforilasi a, chiamata anche fosfoproteina fosfatasi 1 o PP1 (EC 3.1.3.17), catalizza la rimozione dei gruppi fosfato dalla fosforilasi chinasi e dalla glicogeno fosforilasi a, convertendole così in forme inattive (l’enzima rimuove i gruppi fosfato anche dalla glicogeno sintasi). La PP1 è composta da una subunità catalitica, che ha una bassa efficienza catalitica e una bassa affinità per il glicogeno, e dalla già citata subunità G, che appartiene a una famiglia di proteine che legano altre proteine al glicogeno, note come proteine bersaglio del glicogeno (anche la fosforilasi chinasi, la glicogeno fosforilasi e la glicogeno sintasi sono legate alle particelle di glicogeno da proteine di questa famiglia).
PP1 è anche inibita da un’altra proteina chiamata inibitore 1 della PP1.
Come visto in precedenza, PKA fosforila:
- subunità G, che, nella forma fosforilata, non è in grado di legare la subunità catalitica di PP1, e quindi PP1 non incontra i suoi bersagli associati al glicogeno (al contrario, la fosforilazione della subunità G indotta dalla stimolazione dell’insulina, colpendo diversi residui aminoacidici, permette il legame alla subunità catalitica di PP1);
- inibitore-1, che, nella forma fosforilata, è in grado di inibire l’attività di PP1.
Quindi, il legame dell’ormone al suo recettore innesca una reazione a cascata che, tra le altre cose, porta all’inibizione dell’attività della PP1. Questo mantiene fosforilati sia la glicogeno fosforilasi che la glicogeno sintasi: il primo enzima viene attivato mentre il secondo viene inibito. In questo modo, il metabolismo dei carboidrati è ottimizzato.
Regolazione allosterica della glicogenolisi nel muscolo e nel fegato
La glicogenolisi è anche regolata da effettori allosterici sia positivi che negativi. Essi agiscono su tre enzimi: la fosforilasi chinasi muscolare, la glicogeno fosforilasi epatica e muscolare e la PP1.
Fosforilasi chinasi muscolare
L’attività dell’enzima è regolata da due effettori allosterici positivi, ione calcio e AMP, e un effettore allosterico negativo, ATP.
Un aumento della concentrazione intracellulare di ioni calcio è il segnale per la contrazione muscolare e, una volta rilasciato dal reticolo sarcoplasmatico, il calcio si lega alla subunità δ (calmodulina) dell’enzima, attivandolo.
L’AMP si accumula nel muscolo durante la contrazione intensa, a causa del consumo di ATP, e si lega all’enzima e lo attiva. Al contrario, quando la concentrazione di ATP è alta, cioè il muscolo non si contrae, si lega al sito allosterico per l’AMP inattivando la chinasi.
Fosforilasi chinasi epatica
Alcuni ormoni possono agire sia innescando modifiche covalenti delle proteine bersaglio sia causando il rilascio di ioni calcio dal reticolo endoplasmatico. Esempi sono la vasopressina, ma anche l’adrenalina quando si lega ai recettori α1. Per quanto riguarda l’adrenalina, il suo legame ai recettori α1 attiva una proteina G che stimola la fosfolipasi C-β, che a sua volta converte il fosfatidilinositolo-4,5-bisfosfato in inositolo 1,4,5-trifosfato (IP3) e diacilglicerolo. L’inositolo 1,4,5-trifosfato causa il rilascio di ioni calcio dal reticolo endoplasmatico. Gli ioni di calcio, legandosi alla subunità δ della fosforilasi chinasi, portano alla sua attivazione.
Fosforilasi del glicogeno muscolare
La fosforilasi b del glicogeno muscolare si attiva in presenza di alte concentrazioni di AMP, che, legandosi a uno specifico sito di legame nucleotidico, cambia la struttura quaternaria dell’enzima, spostando l’equilibrio allosterico verso lo stato attivo R della forma b. Al contrario, l’ATP e il glucosio-6-fosfato, che competono con l’AMP per lo stesso sito di legame nucleotidico, agiscono come effettori allosterici negativi, spostando l’equilibrio allosterico verso lo stato T inattivo della forma b.
La glicogeno fosforilasi a del muscolo è attiva, indipendentemente dai livelli di AMP, ATP e glucosio-6-fosfato.
Nel muscolo a riposo, quasi tutta la glicogeno fosforilasi è nella forma b inattiva.
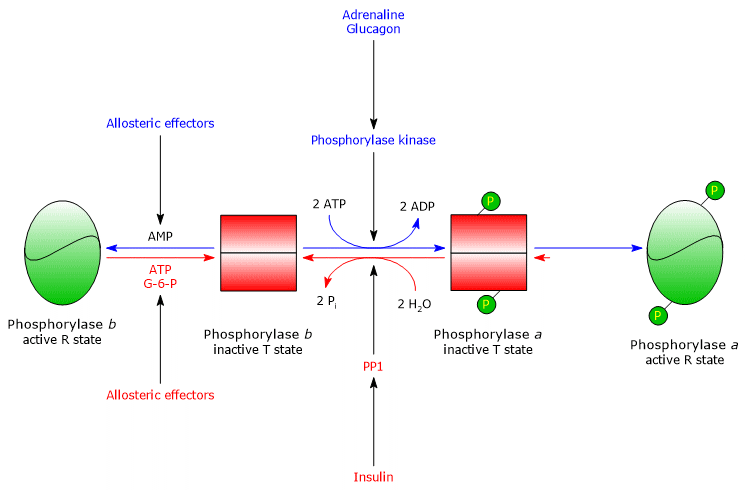
In effetti, la regolazione covalente e allosterica dell’enzima assicura che i livelli di glucosio intracellulare siano finemente regolati.
- Se una cellula con una carica energetica adeguata riceve il segnale ormonale che innesca la cascata di attivazioni, la glicogeno fosforilasi b, inibita dall’ATP e dal glucosio-6-fosfato, rimane nello stato T finché la carica è elevata.
- Se la carica energetica cellulare è bassa, la glicogeno fosforilasi b, attivata dall’AMP, inizia la degradazione del glicogeno, anche in assenza dello stimolo ormonale che induce la sua conversione alla forma a attiva.
Regolazione allosterica della PP1
PP1 è attivata allostericamente dal glucosio-6-fosfato, quindi quando la carica energetica cellulare è bassa.
Fosforilasi del glicogeno epatico
Nel fegato, la regolazione allosterica dell’enzima avviene attraverso meccanismi diversi.
- La prima differenza riguarda la risposta all’AMP: la glicogeno fosforilasi b epatica non è attivata dall’AMP.
- La seconda differenza riguarda la glicogeno fosforilasi a: l’enzima è inibito dal glucosio, che è un inibitore competitivo (il monosaccaride sposta l’equilibrio allosterico verso lo stato T inattivo della forma a.
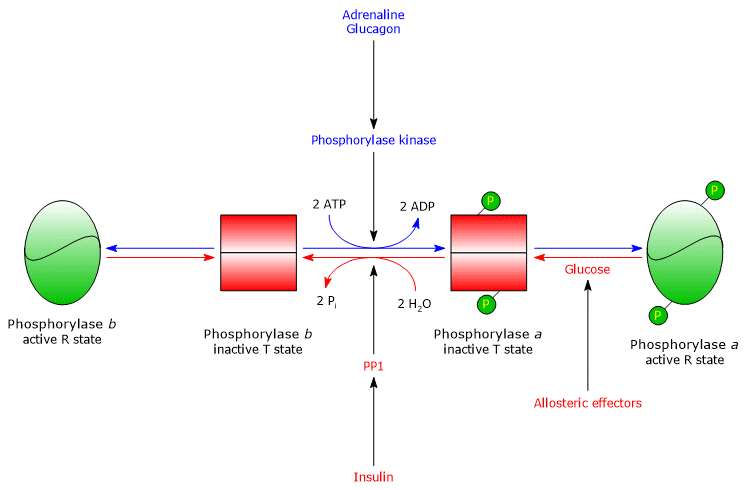
Nel fegato, lo scopo della glicogenolisi è di fornire glucosio ad altri tessuti quando il livello di glucosio nel sangue è basso. Quando il livello di glucosio nel sangue torna alla normalità, la sua concentrazione negli epatociti aumenta e si lega alla glicogeno fosforilasi a, inducendo un cambiamento conformazionale che espone i residui di serina fosforilati all’attività di PP1, che inattiva l’enzima attraverso la defosforilazione. Pertanto, il sito allosterico per il glucosio della glicogeno fosforilasi epatica permette all’enzima di agire come un sensore di glucosio nel sangue, rispondendo adeguatamente ai cambiamenti del livello di glucosio nel sangue. In definitiva, l’isoenzima epatico risponde solo al glucosio, non all’AMP, cioè alla carica energetica cellulare, e questo è degno di nota perché gli acidi grassi, e non il glucosio, sono la fonte primaria di energia per il fegato.
Berg J.M., Tymoczko J.L., and Stryer L. Biochemistry. 5a edizione. W. H. Freeman and Company, 2002
Nelson D.L., M. M. Cox M.M. Lehninger. Principi di biochimica. 4a Ed. W.H. Freeman and Company, 2004
Rawn J.D. Biochimica. Mc Graw-Hill, Neil Patterson Publishers, 1990
Roach P.J., Depaoli-Roach A.A., Hurley T.D., Tagliabracci V.S. Glycogen and its metabolism: some new developments and old themes. Biochem J 2012:441;763-87. doi:10.1042/BJ20111416
Rosenthal M.D., Glew R.H. Medical Biochemistry – Human Metabolism in Health and Disease. John Wiley J. & Sons, Inc., pubblicazione, 2009