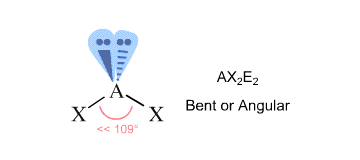Il difluoruro di ossigeno, #”OF”_2#, è una molecola polare perché ha una geometria molecolare piegata.
Questa geometria molecolare assicura che i momenti di dipolo associati ai legami ossigeno – fluoruro non si annullino a vicenda per produrre una molecola nonpolare.
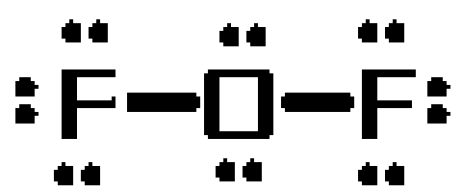
Per vedere perché questo è il caso, disegnate la struttura di Lewis della molecola. La molecola avrà un totale di #20# elettroni di valenza
- #6# dall’atomo di ossigeno
- #7# da ciascuno dei due atomi di fluoro
L’atomo di ossigeno avrà il ruolo di atomo centrale, formando legami singoli con i due atomi di fluoruro. Questi legami rappresenteranno #4# dei #20# elettroni di valenza della molecola.
I risultanti #16# elettroni saranno posti come coppie solitarie
- tre coppie solitarie su ogni atomo di fluoro
- due coppie solitarie sull’atomo di ossigeno
Ora, è molto importante capire che le strutture di Lewis non sono destinate a trasmettere la geometria molecolare!
Per trovare la geometria della molecola, contate le regioni di densità di elettroni che circondano l’atomo centrale – queste vi daranno il numero sterico dell’atomo.
Le regioni di densità elettronica sono i legami con altri atomi (qui i legami singoli, doppi o tripli contano come una regione) e le coppie solitarie di elettroni.
Nel tuo caso, l’atomo di ossigeno centrale è legato ad altri due atomi ed è circondato da due coppie solitarie #-># ha un numero sterico uguale a #4#.
Secondo la teoria VSEPR, questo corrisponde a una geometria molecolare #”AX”_2 “E”_2#, caratteristica di una molecola piegata.
Ora, la differenza di elettronegatività tra fluoro e ossigeno fa sì che i due legami #”O”-“F “# siano polari. La geometria molecolare piegata farà sì che i due momenti di dipolo si sommino tra loro.
Il risultato sarà la formazione di un momento di dipolo permanente, e quindi una molecola polare