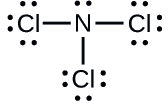Cálculo de las cargas formales
La carga formal de un átomo en una molécula es la carga hipotética que tendría el átomo si pudiéramos redistribuir los electrones de los enlaces uniformemente entre los átomos. Otra forma de decir esto es que la carga formal resulta cuando tomamos el número de electrones de valencia de un átomo neutro, restamos los electrones no enlazantes y luego restamos el número de enlaces conectados a ese átomo en la estructura de Lewis.
Así, calculamos la carga formal de la siguiente manera:
Carga formal = (electrones de valencia del elemento «libre») – (electrones no compartidos) – (enlaces).
Podemos comprobar dos veces los cálculos de la carga formal determinando la suma de las cargas formales de toda la estructura. La suma de las cargas formales de todos los átomos de una molécula debe ser cero; la suma de las cargas formales de un ion debe ser igual a la carga del ion.
Debemos recordar que la carga formal calculada para un átomo no es la carga real del átomo en la molécula. La carga formal es sólo un procedimiento útil de contabilidad; no indica la presencia de cargas reales.
Cálculo de la carga formal a partir de las estructuras de Lewis
Asigne cargas formales a cada átomo en el ion interhalógeno \ce{ICl4-}\.
Solución
Dividimos los pares de electrones de enlace por igual para todos los enlaces \ce{I-Cl}:
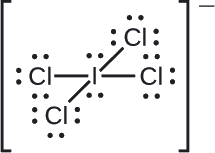
Asignamos pares de electrones solitarios a sus átomos. Cada átomo de Cl tiene ahora siete electrones asignados, y el átomo de I tiene ocho.
Resta este número al número de electrones de valencia del átomo neutro:
- I: 7 – 8 = -1
- Cl: 7 – 7 = 0
La suma de las cargas formales de todos los átomos es igual a -1, que es idéntica a la carga del ion (-1).
Calcule la carga formal de cada átomo de la molécula de monóxido de carbono:

Responde
C -1, O +1
Calcular la carga formal a partir de las estructuras de Lewis
Asigna cargas formales a cada átomo de la molécula interhalógena \ce{BrCl3}\).
Solución
Asigna uno de los electrones de cada enlace Br-Cl al átomo de Br y otro al átomo de Cl en ese enlace:
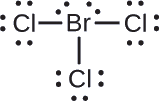
Asigna los pares solitarios a su átomo. Ahora cada átomo de Cl tiene siete electrones y el átomo de Br tiene siete electrones.
Resta este número al número de electrones de valencia del átomo neutro. Esto da la carga formal:
- Br: 7 – 7 = 0
- Cl: 7 – 7 = 0
Todos los átomos de la \ce{BrCl3}\Ntienen una carga formal de cero, y la suma de las cargas formales suma cero, como debe ser en una molécula neutra.
Determine la carga formal de cada átomo en \ce{NCl3}.
Respuesta
N: 0; los tres átomos de Cl: 0