El nitrato de magnesio representado por la fórmula química Mg(NO3)2 o MgN2O6 que lleva el nombre IUPAC de dinitrato de magnesio es un polvo blanco cristalino higroscópico que es soluble en agua y alcohol . Es una sal de magnesio y contiene enlaces químicos de naturaleza iónica .

Nitrato de magnesio
Identificación del nitrato de magnesio |
|
| Número CAS | 10377-60-3 |
| PubChem CID | 25212 | ChemSpider ID | 23415 |
| Número CE | 233-826-7 |
Composición y síntesis
El nitrato de magnesio se puede preparar combinando sulfato de magnesio con nitrato de calcio .
MgSO4 + Ca(NO3)2 = Mg(NO3)2 + CaSO4
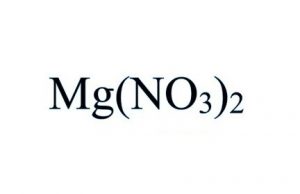
Fórmula del nitrato de magnesio
Propiedades y características del nitrato de magnesio Nitrato de magnesio
Propiedades generales Propiedades |
||
| Masa molecular/peso molecular | 148.313 g/mol | |
Propiedades físicas |
||
| Color/apariencia | Cristales blancos | |
| Punto de fusión/punto de congelación | 89°C, 192.2°F | |
| Punto de ebullición | 330°C, 626°F | |
| Densidad | 1.46 g cm-3 | |
| Estado de la materia a temperatura ambiente (fase normal) | Sólido | |
Propiedades químicas Propiedades |
||
| Solubilidad en agua | 42 g/100 ml (a 20oC) | |
| pH | 5-7 (ácido) | |
Propiedades atómicas |
||
| Estructura cristalina estructura | Cúbica | |
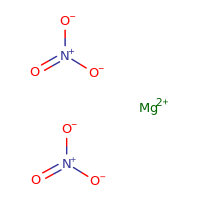
Estructura del Nitrato de Magnesio
Reacciones prominentes del Mg(NO3)2
Una reacción química entre el nitrato de magnesio y el carbonato de sodio produce carbonato de magnesio y nitrato de sodio .
Mg(NO3)2 + Na2CO3 = MgCO3 + 2NaNO3
El nitrato de magnesio se descompone en agua formando hidróxido de magnesio, amoníaco y oxígeno .
El Mg(NO3)2 + 4H2O = Mg(OH)2 + 2NH3 + 4O2
Al calentar el Mg(NO3)2, se descompone en óxido de magnesio, dióxido de nitrógeno y oxígeno.
2Mg(NO3)2 = 2MgO + 4NO2 + O2
Reacciona con hidróxido de sodio para dar hidróxido de magnesio y nitrato de sodio .
Mg(NO3)2 + 2NaOH = Mg(OH)2 + 2NaNO3
Usos del nitrato de magnesio
- Como fuente segura de iones nitrato .
- En la producción de fertilizantes nitrogenados .
- En pirotecnia y fabricación de ácido nítrico concentrado .
- Ayuda en el prilado y recubrimiento para la producción de nitrato de amonio y es un ingrediente de cosméticos y champús .
- Nitrato de magnesio – Pubchem.ncbi.nlm.nih.gov
- Nitrato de magnesio – Chemspider.com/li>
- Nitrato de magnesio – Americanelements.com
- Nitrato de magnesio – Sciencemadness.org
- Nitrato de magnesio hexahidratado – Sigmaaldrich.com
- Nitrato de magnesio – Chemicalbook.com
- Pregunta: Nitrato de magnesio y carbonato de sodio Mg(NO_3)_2 + Na_2 – Chegg.com
- ¿Cómo se determina la ecuación equilibrada del nitrato de magnesio más agua? – Quora.com
- La descomposición térmica del nitrato de magnesio – Chemiday.com
- Pregunta: El hidróxido de sodio reacciona con el nitrato de magnesio para formar hidróxido de magnesio – Chegg.com
Es peligroso
Al ser un oxidante fuerte, puede causar un peligro de incendio. También puede causar un peligro de explosión cuando se pone en contacto con sustancias orgánicas. Debe evitarse el contacto con los ojos, la piel y la inhalación, ya que produce irritación, tos y dificultad para respirar. La ingestión en grandes cantidades produce dolor abdominal, mareos, diarrea con sangre, vómitos, convulsiones, debilidad y colapso.
.