Introducción
Las enfermedades autoinmunes representan una gran variedad de problemas clínicos que afectan a múltiples órganos y sistemas, y afectan al menos al 5% de la población.1 Se ha asociado una gran diversidad de anticuerpos con diferentes manifestaciones clínicas y los clínicos se han basado en ellos para guiar el diagnóstico clínico, las implicaciones pronósticas y, en algunos casos, las decisiones terapéuticas.2,3 Los conocimientos actuales sobre la patogénesis de las enfermedades autoinmunes coinciden en que es necesaria una compleja interacción de genes y características ambientales para que aparezcan.4
La combinación de las técnicas de ensayo ENA de inmunoblot de línea (INNOLIA-ANA) y de inmunofluorescencia indirecta para detectar anticuerpos antinucleares en células HEp-2 como sustrato son buenos métodos de cribado en pacientes con sospecha clínica de una enfermedad autoinmune, principalmente lupus eritematoso sistémico (LES) y síndrome de Sjögren (SS). Aunque pueden producirse resultados falsos positivos, los títulos >1:80 sugieren la posibilidad de un trastorno autoinmune y deben incitar a solicitar evaluaciones más específicas para determinar las reactividades específicas de los anticuerpos antinucleares (ANA), como los anti ADN de doble cadena y los antígenos nucleares extraíbles (ENA).5
Ro/SSA y La/SSB son complejos antigénicos heterogéneos formados por tres proteínas diferentes (Ro-52, Ro-60 y La) y cuatro partículas de ARNY. La proteína Ro60 actúa como un punto de control de calidad para los ARN mal plegados con chaperonas moleculares para los ARN defectuosos. Los ARN mal plegados son reconocidos y luego marcados por Ro60 para su degradación. Ro52 interactúa con diferentes moléculas, entre ellas la calreticulina y la proteína de unión a la cadena pesada de la inmunoglobulina. Se cree que Ro52 modifica el papel o la estabilidad de sus sustratos a través de la ubiquitinación, y esta modificación podría dar lugar a los eventos biológicos mediados por Ro52.6
Se han descrito anticuerpos anti-Ro/SSA y anti-La/SSB en varias enfermedades autoinmunes. En el síndrome de Sjögren primario (SSp) se detectan anticuerpos circulantes en aproximadamente el 60-70% de los pacientes, y los niveles más elevados se han asociado con la aparición temprana de la enfermedad y las manifestaciones sistémicas.7,8 El Grupo de Estudio GEMESS, que incluyó 12 centros de referencia en España, confirmó estas características clínicas y de laboratorio en una cohorte de pacientes con SSp, y observó una disminución de los niveles de C4 en los pacientes con aparición temprana de la enfermedad.9
Los anti-Ro/SSA se detectan en el 30% de los pacientes con diagnóstico de LES, particularmente (90%) en aquellos subtipos con inicio tardío, lupus eritematoso cutáneo subagudo, lupus inducido por fármacos y deficiencias congénitas de C2, C4 y C1q, también en pacientes con síndrome de solapamiento SS/SLE y enfermedad indiferenciada del tejido conectivo.10 Por el contrario, el anti-La/SSB se asocia más comúnmente con el SS,11 y se correlaciona fuertemente en los anti-La/SSB positivos con los anti-Ro/SSA negativos con la disfunción de órganos (riñón, pulmón, hígado).12
Desde los años ochenta, se ha descrito el desarrollo de bloqueo cardíaco congénito en enfermedades autoinmunes, como el SS y el LES. Sin embargo, la afectación cardíaca está más relacionada con los anticuerpos circulantes de la madre que con el diagnóstico de la enfermedad autoinmune. Aunque el perfil inmunológico es variable entre diferentes estudios el anticuerpo anti-Ro52 es más común en madres de niños con bloqueo cardíaco congénito, lupus neonatal y neonatos con QT prolongado sin bloqueo cardíaco congénito.10,13,14
La prevalencia y las asociaciones clínicas de los anticuerpos anti-Ro/SSA y anti-La/SSB pueden variar en diferentes grupos étnicos. Además de los estudios realizados en la población española sobre la expresión inmunológica del SS, en los últimos años se han desarrollado otros estudios sobre el perfil inmunológico de los pacientes con anticuerpos anti-Ro52, anti-Ro60 y anti-La. La mayoría de ellos se han realizado sobre diagnósticos específicos de trastornos del tejido conectivo. En una cohorte de pacientes con SSP desarrollada en Corea se observaron asociaciones de estos anticuerpos con diferentes manifestaciones clínicas. El anti-Ro52 fue el autoanticuerpo más frecuente y se relacionó con el daño hepático y muscular.15 Un estudio reciente en población mexicana para determinar la prevalencia del SSp en el LES de inicio reciente mostró la presencia de anti-Ro/SSA como predictor de solapamiento, mientras que la ausencia de anti-Ro/SSA, anti-La/SSB y factor reumatoide se relacionó con el menor riesgo de solapamiento.16 Por último, el Hospital Universitario de Gante propuso un estudio para determinar la distribución diagnóstica asociada al serotipo de anti-Ro/SSA o anti-La/SSB en pacientes consecutivos remitidos al laboratorio de reumatología. El LES se asoció a anti-Ro60 positivo y el anti-La aislado predisponía más al pSS.17
Empezamos este estudio para evaluar las asociaciones clínicas, de laboratorio y de diagnóstico de este importante subconjunto de anticuerpos en un hospital de España.
MétodosCentro de investigación
El Hospital de Jerez de la Frontera es un centro regional de especialidades situado en el suroeste de España. Ofrece servicios clínicos especializados y cuenta con 550 camas. Su Servicio de Inmunología analiza alrededor de 5800 pruebas de ANA y 1700 ensayos de ENA por inmunoblot al año en una población de 450.000 habitantes. Entre su personal de laboratorio hay un biólogo y un inmunólogo que realizan pruebas especializadas para diferentes departamentos. Cualquier clínico en ejercicio puede solicitar pruebas de anticuerpos antinucleares, pero son principalmente solicitadas por reumatólogos, seguidos por médicos de atención primaria, gastroenterólogos, internistas, nefrólogos, neumólogos y hematólogos.
Muestras
Un registro informatizado de los resultados de laboratorio está disponible desde junio de 2002. Se analizaron de forma retrospectiva todas las muestras consecutivas que solicitaron la prueba de ANA desde junio de 2002 hasta diciembre de 2012. Los sueros con un título de al menos 1:160 por ensayo de inmunofluorescencia en células HEp-2 (Euroimmun, Alemania) se consideraron positivos y fueron realizados por un único observador capacitado. Los sueros con una prueba de ANA positiva para esta dilución de título se analizaron mediante un ensayo de inmunoblot de línea de ENA disponible en el mercado (INNO-LIA ANA, Fujirebio, Japón). Este kit proporciona un ensayo cualitativo in vitro para autoanticuerpos humanos de la clase IgG contra 13 antígenos diferentes: RNP-70, RNP-A, RNP-C, Ro-52, Ro-60, La/SSB, Scl-70, CENP-B, histonas, Jo-1, Sm, proteína ribosomal P y complejo U1-nRNP en suero o plasma. La sensibilidad y especificidad global de la detección de autoanticuerpos por LIA fue similar o superior en comparación con las técnicas convencionales combinadas.18,19 Este inmunoblot tiene una especificidad del 99,6% para el anti-La, mientras que el anti-Ro60 tiene un 98,2%, y el anti-Ro52 tiene un 98,3%.20
Además, el sistema informático nos permite detectar en el inmunoensayo anti-Ro y/o anti-La positivos con prueba de ANA negativa, ya que en pacientes con alta sospecha clínica de una enfermedad autoinmune se realizó el ensayo de ENA por inmunoblot a pesar de una prueba de ANA negativa. Por último, sólo se incluyeron en el estudio los pacientes con más de una muestra de suero positiva para anti-Ro/SSA o anti-La/SSB.
Los datos clínicos y de laboratorio fueron obtenidos por dos observadores entrenados mediante la revisión de las historias clínicas o una base de datos de laboratorio informatizada.
Variables
Las variables independientes incluyeron datos demográficos (edad, sexo), clínicos (diagnóstico, características de la enfermedad), de laboratorio (hemoglobina, recuentos de leucocitos y plaquetas, niveles de hormonas tiroideas) o inmunológicos (niveles de complemento, hipergammaglobulinemia, factor reumatoide).
Análisis estadístico
Se utilizaron estadísticas descriptivas con frecuencias y porcentajes para las variables cualitativas y media, desviación estándar y rango para las variables cuantitativas. Las asociaciones clínicas entre los diferentes conjuntos de combinaciones positivas frente a las variables clínicas o de laboratorio se analizaron mediante tablas de contingencia utilizando las pruebas de chi cuadrado o exacta de Fisher. En todos los casos, el nivel alfa se fijó en 0,01 como ajuste para las comparaciones múltiples. La fuerza de la asociación se presenta como odds ratio y sus intervalos de confianza del 99%. Se realizó el análisis de conglomerados de las variables utilizando el promedio de vinculación entre grupos, y utilizando como medida de intervalo, la distancia euclidiana al cuadrado. Los análisis se realizaron utilizando el SPSS 16.0 (SPSS Inc., Chicago, IL).
Resultados
Un total de 41.102 muestras de suero fueron remitidas al Departamento de Inmunología para la detección de ANA. 12.124 muestras fueron positivas de 2970 pacientes. Se incluyeron 322 pacientes con más de una muestra de suero positiva para anticuerpos anti-Ro52 y/o anti-Ro60 y/o anti-La con dilución de título >160. Las mujeres representaron el 90,4% de la muestra. Tenían una edad entre 10 y 84 años, con una media de 44,4 y una desviación estándar de 15,7 años. Algunos sueros aislados fueron positivos para el ensayo de inmunoblot de ENA con prueba de ANA negativa. Pero los 322 pacientes mostraron todos o la mayoría de sus sueros positivos para la prueba de ANA, y el patrón de sueros de cada paciente era prácticamente idéntico. En nuestro estudio no se encontró ningún paciente con más de una prueba de suero negativa para IIF.
Los principales datos clínicos y de laboratorio de los pacientes con muestras positivas para anti-Ro52 y/o anti-Ro60 y/o anti-La (322 casos) se presentan en la Tabla 1. Las especificidades de los diferentes antígenos de estos pacientes se representan en la Tabla 2. Podemos ver que el hallazgo positivo más frecuente fue anti-Ro52 en 269 pacientes (83,5%), seguido de 205 pacientes con anti-Ro60 (63,7%) y 155 con anti-La (48,1%).
La tabla 3 muestra diferentes asociaciones entre las combinaciones de anticuerpos anti-Ro52/anti-Ro60/anti-La y el diagnóstico, la clínica o los resultados del laboratorio. La tabla 4 muestra las asociaciones significativas de la prueba positiva para la presencia de anticuerpos circulantes anti-Ro52, anti-Ro60 y anti-La. Dado que se seleccionó un nivel de significación estricto, no se presentaron algunas asociaciones interesantes, como el grupo anti-Ro52+ con patrón citoplásmico (OR 3,72, IC del 99%: 0,9-16, valor de p 0,04) y el grupo anti-Ro60+ con lupus cutáneo subagudo (SCLE) (OR 7,0, IC del 99%: 0,9-55,3, p: 0,023).
Utilizando el análisis de conglomerados, se pueden identificar cuatro grupos de autoanticuerpos. El grupo 1 comprende anticuerpos contra SmB, SmD, RNP,70, RNP-A y RNP-C. El grupo 2 está formado por anticuerpos contra Scl-70, Ribosomal P, Jo1 y centrómero. El clúster 3 está formado por anticuerpos contra Ro60 y SSB. El cluster 4 está formado por anticuerpos contra Ro52 (Fig. 1).
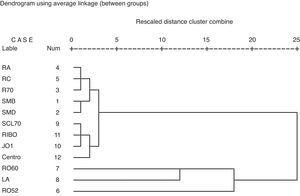
Análisis de cluster para identificar el cluster de anticuerpos en nuestra muestra de pacientes.
Los reumatólogos han establecido la importancia de los hallazgos clínicos y serológicos en la clasificación de muchas enfermedades autoinmunes. Se han publicado algunas preocupaciones sobre la importancia de la evaluación crítica de las pruebas especializadas en la atención clínica. Parece que la solicitud de muchas pruebas podría producir múltiples resultados de laboratorio que deben ser cuidadosamente evaluados en el contexto de los hallazgos clínicos.17,21
En nuestro estudio describimos las asociaciones clínicas, diagnósticas e inmunológicas con todas las diversas combinaciones posibles de anticuerpos anti-Ro52, anti-Ro60 y anti-La, encontradas en una gran cohorte de pacientes de un único centro en España durante 10 años. Un total de 322 pacientes presentaron más de una positividad para estos anticuerpos, y las enfermedades más prevalentes fueron el LES y el SSP, asociadas principalmente con el perfil inmunológico anti-Ro52+/anti-Ro60+/anti-La- y anti-Ro52+/anti-Ro60+/anti-La+, respectivamente.
Nuestra estricta definición de significación estadística podría hacer que se perdieran algunas asociaciones, pero confiamos en que las asociaciones descritas puedan ser más robustas. La relevancia clínica y práctica de estas asociaciones podría ser particularmente interesante para los anti-Ro52 aislados (anti-Ro52+/anti-Ro60-/anti-La-). Este subconjunto de autoanticuerpos tiene asociaciones clínicas e inmunológicas independientes, datos confirmados en nuestro análisis de grupos.22,23 El anticuerpo anti-Ro52 aislado positivo se asoció con la esclerosis sistémica, especialmente con aquellos con síndrome CREST, y con la dermatomiositis (OR 11,65, IC del 99%: 1,28-105,79, p: 0,018). Otras asociaciones se observaron principalmente con algunos hallazgos de laboratorio como el anti-Jo-1 (OR 3,45, IC del 99%: 1,12-10,59, p: 0,03), el anticéntrico (OR 2,66, IC del 99%: 1,04-2,80, p: 0,03) o patrones de inmunofluorescencia particulares como el patrón centromérico, citoplasmático y nucleolar. Además, al comparar el grupo aislado positivo anti-Ro52+ (anti-Ro52+/anti-Ro60-/anti-La-) con la triple reactividad positiva (anti-Ro52+/anti-Ro60+/anti-La+), las asociaciones clínicas, de laboratorio y de diagnóstico encontradas en un grupo fueron opuestas en el otro. Así, el subconjunto inmunológico anti-Ro52+/anti-Ro60+/anti-La+ se asoció positivamente a la xerostomía y al patrón moteado fino y negativamente a la esclerosis sistémica (OR 0,22; IC del 99%: 0,05-1,00; p: 0,026). Esto pone de manifiesto el valor clínico diagnóstico de la combinación. En relación con el resultado positivo de la prueba para el grupo de anti-Ro60+, principalmente asociado con anti-La- (anti-Ro52+/anti-Ro60+/anti-La- y anti-Ro52-/anti-Ro60+/anti-La-), fue muy indicativo de LES.
Nuestros hallazgos son similares a los reportados previamente.6,22-25 La presencia de anticuerpos circulantes anti-Ro52, anti-Ro60 y anti-La positivos predisponen a la xerostomía y a la xeroftalmia (xerostomía en anti-Ro60 OR 1,75, IC del 99%: 1,10-2,79, p: 0,012). Estos datos clínicos están respaldados por numerosos estudios sobre el SSP.6-9,11,17,24 Los anti-Ro52 positivos con anti-Ro60 y anti-La negativos mostraron una asociación negativa con la fotosensibilidad, aunque en estudios anteriores los pacientes con anti-Ro52+ tenían una mayor frecuencia de afectación cutánea.17,26 Además, esta combinación inmunológica (anti-Ro52+/anti-Ro60-/anti-La-) también se asoció inversamente con la xerostomía y la xeroftalmia. Sin embargo, en estudios anteriores, los anti-Ro52 positivos aislados estaban estrechamente relacionados con las principales características clínicas, histopatológicas e inmunológicas del SSp.27 Los anti-Ro60 positivos aislados o los anti-Ro60+ combinados con los anti-Ro52+ aumentaban la probabilidad de LES o de superposición de LES/SS, como se ha descrito en varios trabajos,11,17,28 pero también en nuestra cohorte estaban fuertemente asociados a las úlceras orales y la artritis. La reactividad anti-La estaba fuertemente asociada al SSP y a sus principales manifestaciones clínicas (xerostomía y xeroftalmia), al igual que en muchos otros estudios en diferentes poblaciones.11,17,26
La mayoría de los estudios de investigación previos sobre la utilidad de estos anticuerpos se han realizado en muestras de pacientes con una enfermedad autoinmune diagnosticada, especialmente LES y SS. Sin embargo, hay pocos estudios realizados para describir la asociación diagnóstica de los anticuerpos anti-Ro y anti-La identificados en una muestra consecutiva.17
Además del diagnóstico, se determinó la utilidad de los perfiles inmunológicos con anti-Ro52 y/o anti-Ro60 y/o anti-La en la predicción de datos clínicos y de laboratorio en una muestra consecutiva de pacientes y que están ordenados para todos los departamentos de atención hospitalaria y primaria. Revisamos todas las muestras de cada paciente durante este periodo y registramos la combinación de reactividad anti-Ro52, anti-Ro60 y anti-La más prevalente. El punto de corte de positividad seleccionado >160 aumenta la validez del estudio, debido a que la prueba de ANA positiva y el ensayo anti-Ro/SSA y anti-La/SSB pueden detectarse hasta en el 25-30% y el 1,6% de los individuos sanos, respectivamente. Su prevalencia es mayor con la edad, y su positividad sin un dato clínico relevante puede inducir a error.29
Por tanto, en nuestro estudio demostramos que un perfil inmunológico puede llevarnos a un diagnóstico determinado o al desarrollo de manifestaciones de la enfermedad. Esto es más importante en el inicio de las enfermedades autoinmunes, debido a que los anticuerpos circulantes pueden estar presentes varios años antes del diagnóstico de la enfermedad, y podrían indicar la gravedad de sus manifestaciones.17,30
Algunas limitaciones inherentes a estos estudios son las evaluaciones clínicas retrospectivas de las historias clínicas y los posibles sesgos diagnósticos de los médicos tratantes que ven a estos pacientes y solicitan pruebas de laboratorio especializadas. Muchos de nuestros pacientes con prueba de ANA positiva resultaron negativos en la determinación del ensayo de ENA por inmunoblot. Esto podría estar relacionado con el tipo de inmunoensayo desarrollado. En los casos con una alta sospecha clínica se recomienda la detección de anticuerpos específicos.11
Divulgaciones éticasProtección de sujetos humanos y animales
Los autores declaran que en esta investigación no se han realizado experimentos en humanos ni en animales.
Confidencialidad de los datos
Los autores declaran que han seguido los protocolos del centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la intimidad y consentimiento informado
Los autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.