La glucogenólisis, o descomposición del glucógeno, libera glucosa cuando se necesita.
En el hígado, el glucógeno es una reserva de glucosa para el mantenimiento de los niveles normales de glucosa en sangre, y su descomposición se produce principalmente:
- en el estado de ayuno, por ejemplo, durante el ayuno nocturno;
- entre las comidas;
- durante una actividad física de alta intensidad.
- Pasos de la glucogenólisis
- Destino metabólico de la glucosa 1-fosfato en el músculo y el hígado
- Regulación covalente de la glucogenólisis en el músculo y el hígado
- β-.Receptores adrenérgicos
- Proteínas G estimuladoras
- Adenil ciclasa
- Proteína quinasa A
- Fosforilasa quinasa
- Regulación alostérica de la glucogenólisis en músculo e hígado
- Fosforilasa quinasa muscular
- Hepática fosforilasa quinasa
- Glicógeno fosforilasa muscular
- Regulación alostérica de la PP1
- Glicógeno fosforilasa hepática
- Glucosa 1-fosfato (alrededor del 90% de las moléculas de glucosa liberadas);
- una pequeña cantidad de glucosa libre, el 10% restante ;
- una molécula de glucógeno más pequeña y menos ramificada.
- la adrenalina (también conocida como epinefrina), producida por las glándulas suprarrenales, que actúa, por ejemplo, sobre los músculos, el hígado y las células grasas;
- el glucagón, producido por las células alfa del páncreas, que actúa sobre los hepatocitos y los adipocitos.
- un aumento de la degradación del glucógeno en las células musculares y hepáticas;
- un aumento de la degradación de los triglicéridos (lipólisis) en el tejido adiposo.
- la glucógeno sintasa (EC 2.4.1.11), inhibida;
- lipasa sensible a las hormonas (EC 3.1.1.79), activada;
- fosfofructoquinasa 2/fructosa-2,6-bisfosfatasa (EC 2.7.1.105 y EC 3.1.3.46 respectivamente), activada;
- inhibidor-1 y la subunidad de unión al glucógeno (G) de la proteína fosfatasa 1, activados;
- fosforilasa quinasa, activada.
- T, de tenso o tensado, que es menos activo;
- R, de relajado, que es más activo, y capaz de unirse al glucógeno, también en estado fosforilado (ver más adelante).
- La subunidad G, que, en la forma fosforilada, no es capaz de unirse a la subunidad catalítica de la PP1, y por tanto la PP1 no se encuentra con sus objetivos asociados al glucógeno (por el contrario, la fosforilación de la subunidad G inducida por la estimulación de la insulina, afectando a diversos residuos aminoácidos, permite la unión a la subunidad catalítica de la PP1);
- inhibidor-1, que, en la forma fosforilada, es capaz de inhibir la actividad de la PP1.
- Si una célula con una carga energética adecuada recibe la señal hormonal que desencadena la cascada de activaciones, la glucógeno fosforilasa b, inhibida por el ATP y la glucosa-6-fosfato, permanece en el estado T hasta que la carga sea alta.
- Si la carga energética celular es baja, la glucógeno fosforilasa b, activada por el AMP, inicia la descomposición del glucógeno, incluso en ausencia del estímulo hormonal que induce su conversión a la forma activa a.
- La primera diferencia se refiere a la respuesta al AMP: la glucógeno fosforilasa b hepática no se activa por el AMP.
- La segunda diferencia se refiere a la glucógeno fosforilasa a: la enzima es inhibida por la glucosa, que es un inhibidor competitivo (el monosacárido desplaza el equilibrio alostérico hacia el estado T inactivo de la forma a.
En los hepatocitos, la glucogenólisis es estimulada por el glucagón y la adrenalina, inhibida por la insulina y sujeta a una regulación alostérica negativa también por la glucosa (véase más adelante).
En el músculo, el glucógeno es una fuente de energía para la actividad muscular; por lo tanto, la degradación del glucógeno se produce durante la contracción, y sólo en los músculos implicados en la actividad.
En las células musculares, la glucogenólisis es estimulada por la adrenalina, y regulada por efectores alostéricos positivos y negativos, el AMP y el ion calcio (Ca2+), y el ATP y la glucosa 6-fosfato, respectivamente (ver más abajo).
CONTENIDOS
Pasos de la glucogenólisis
La glucogenólisis comienza por la acción de la glucógeno fosforilasa (EC 2.4.1.1), un homodímero que para su actividad requiere la presencia de piridoxal-5-fosfato, un derivado de la piridoxina o vitamina B6. La enzima cataliza la escisión fosforolítica del enlace α-(1,4) glicosídico, liberando moléculas de glucosa de una en una desde los extremos no reductores, es decir, los extremos con un grupo 4′-OH libre, de las ramas externas. Esta reacción, que no consume ATP sino un ortofosfato, produce glucosa 1-fosfato.
Glicógeno(n residuos de glucosa) + Pi → Glucosa 1-fosfato + Glucógeno(n-1 residuos de glucosa)
Nota: en el intestino delgado, la α-amilasa pancreática (EC 3.2.1.1) cataliza la escisión hidrolítica de los enlaces α-(1,4) glicosídicos del almidón, y da lugar a moléculas de glucosa.
En vivo, la glucógeno fosforilasa cataliza una fosforólisis irreversible, una reacción especialmente ventajosa para el músculo esquelético y el corazón (véase más adelante). La irreversibilidad de la reacción está garantizada por la relación /, que suele ser superior a 100. Por el contrario, la reacción es fácilmente reversible in vitro.
La glucógeno fosforilasa actúa repetidamente sobre los extremos no reductores de las ramificaciones, deteniéndose cuando se alcanza la unidad de glucosa que está a 4 residuos del punto de ramificación: este es el límite exterior de la dextrina límite. En este punto, dos actividades enzimáticas, presentes en la misma cadena polipeptídica, completan la descomposición del glucógeno: la α-(1,4)-glucano-6-glicosiltransferasa (EC 2.4.1.24) y la amilo-α-(1,6)-glucosidasa o enzima desramificadora (EC 3.2.1.33). La primera actividad enzimática transfiere tres de las cuatro unidades de glucosa restantes de la rama al extremo no reductor de otra rama, dejando en la primera cadena una sola unidad de glucosa, que está unida a la cadena por un enlace α-(1,6)-glicosídico. La segunda actividad enzimática hidroliza este enlace α-(1,6)-glicosídico, liberando glucosa y una cadena no ramificada de unidades de glucosa unidas por α-(1,4).
Sin la ramificación, la glucógeno fosforilasa puede seguir eliminando unidades de glucosa hasta llegar a la siguiente dextrina límite.
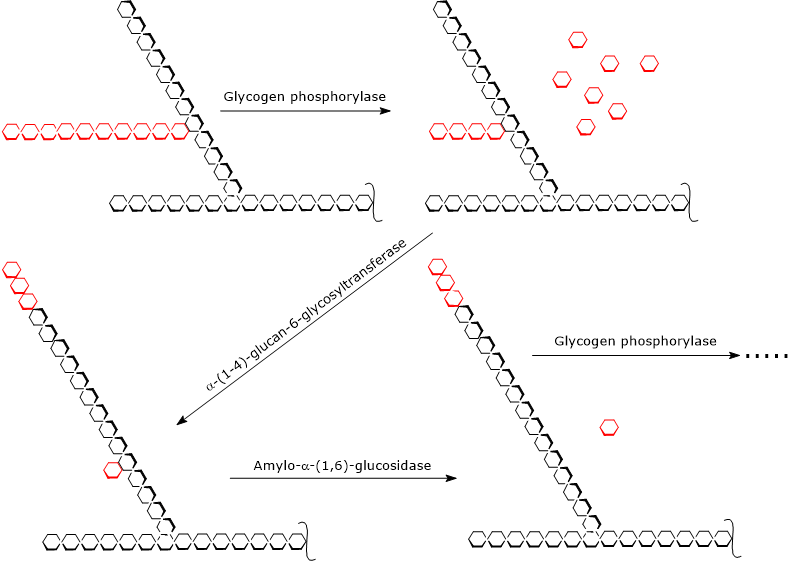
Por tanto, los productos de las reacciones catalizadas por las tres actividades enzimáticas son:
Destino metabólico de la glucosa 1-fosfato en el músculo y el hígado
La glucosa 1-fosfato es una molécula cargada, por lo que queda atrapada dentro de la célula.
Se convierte en glucosa 6-fosfato en la reacción catalizada por la fosfoglucomutasa (EC 5.4.2.2), la misma enzima que también interviene en la síntesis del glucógeno convirtiendo la glucosa 6-fosfato en glucosa 1-fosfato. Esta enzima cataliza una reacción reversible: el sentido está determinado por las concentraciones relativas de las dos moléculas, y en este caso mueve el grupo fosfato de C1 a C6.
Glucosa 1-fosfato ⇄ Glucosa 6-fosfato
En el músculo, y en la mayoría de los demás órganos y tejidos, la glucosa procedente de la glucogenólisis entra en la glucólisis como glucosa 6-fosfato, saltándose el paso de activación catalizado por la hexoquinasa. Por lo tanto, la glucógeno fosforilasa, al liberar una molécula de glucosa ya «activada», ahorra un ATP. Se requiere una molécula de ATP para sintetizar otro intermediario glucolítico, la fructosa 1,6-bifosfato.
De esta manera, se conserva parte de la energía de activación requerida para la síntesis de glucógeno: el rendimiento neto de ATP por molécula de glucosa por glucólisis a lactato es de 3 en lugar de 2, una ventaja para el músculo que trabaja. La ecuación general es:
Glicógeno(n residuos de glucosa) + 3 ADP + 3 Pi → Glucógeno(n-1 residuos de glucosa) + 2 Lactato + 3 ATP
En el hígado, la glucosa 6-fosfato del glucógeno es desfosforilada por la glucosa 6-fosfatasa (EC 3.1.3.9), y luego liberada al torrente sanguíneo. Estos son los pasos en la eliminación de unidades de glucosa, en forma de glucosa fosforilada, por la glucogenólisis hepática:
Glicógeno(n residuos de glucosa) + Pi → Glucosa 1-Fosfato + Glucógeno(n-1 residuos de glucosa)
glucosa-1-fosfato → glucosa-6-fosfato
glucosa-6-fosfato + H2O → glucosa + Pi
La ecuación global es:
Glicógeno(n residuos de glucosa) + H2O → Glucógeno(n-1 residuos de glucosa) +Glucosa
Regulación covalente de la glucogenólisis en el músculo y el hígado
La degradación del glucógeno está bajo un fino control a través de modificaciones covalentes y/o alostéricas de algunas proteínas clave, como la fosforilasa quinasa (EC 2.7.11.19), la fosforilasa del glucógeno y la proteína fosfatasa 1.
Aquí se analizan los efectos de dos hormonas, que actúan a través de modificaciones covalentes de las proteínas diana:
Estas hormonas, al unirse a sus receptores de membrana, desencadenan una cascada idéntica de acontecimientos intracelulares que amplifican en varios órdenes de magnitud su señal, estimulando la glucogenólisis e inhibiendo la síntesis de glucógeno.
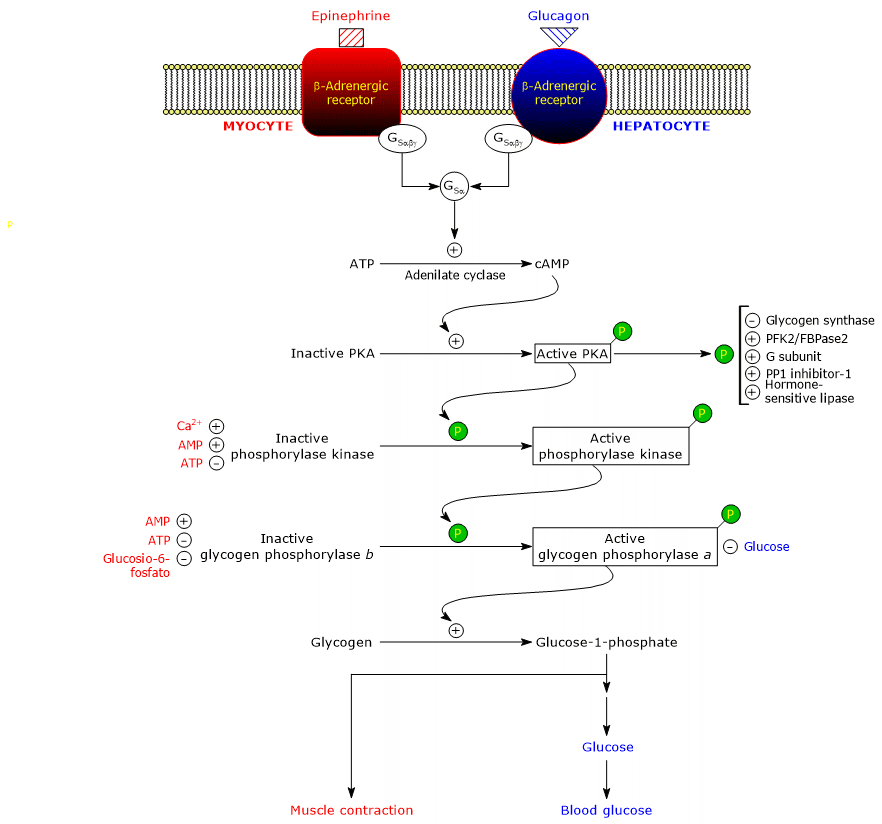
Hay que señalar que incluso la acetilcolina, al unirse al receptor situado en la unión neuromuscular, desencadena la misma cascada de activaciones de la adrenalina y el glucagón.
Aquí, las proteínas implicadas en la cascada.
Receptores beta-adrenérgicos
Los receptores para la adrenalina y el glucagón son proteínas integrales de membrana, con siete α-hélices transmembrana.
El término «adrenérgico» deriva de adrenalina. Existen cuatro subtipos de receptores adrenérgicos: α1, α2, β1 y β2. En la discusión posterior, sólo se considerarán los receptores β1 y β2, denominados β, y que actúan de la misma manera.
Los receptores adrenérgicos β provocan cambios en el metabolismo energético, como:
Proteínas G estimuladoras
La unión de la hormona al receptor provoca un cambio conformacional en la porción citosólica del receptor, y esto modifica la interacción con la segunda proteína de la cascada: la proteína estimuladora de unión a nucleótidos de guanina o, más simplemente, proteína G estimuladora (GS). Se trata de un heterotrímero compuesto por tres subunidades: α (que contiene el sitio de unión del nucleótido), β y γ. En la forma inactiva, GSαβγ-GDP, el heterotrímero se acopla a los receptores β-adrenérgicos.
Los cambios conformacionales del receptor le permiten catalizar la sustitución del GDP por GTP en la subunidad α del complejo GSαβγ. Esto conduce a la disociación del trímero en un dímero inactivo, βγ, y el complejo GSα-GTP que se desplaza a lo largo del plano de la superficie interna de la membrana plasmática, a la que está anclado por un grupo palmitoilo unido covalentemente, hasta alcanzar la adenilil ciclasa (EC 4.6.1.1).
Nota: la acción de la GS se asemeja a la de las proteínas Ras, otra clase de proteínas G que participan en la transducción de señales de la insulina.
Adenil ciclasa
Es una enzima integral de membrana, cuyo sitio activo se encuentra en el lado citosólico de la membrana plasmática. La interacción entre la GSα y la adenil ciclasa activa la enzima que, a su vez, cataliza la síntesis de AMPc a partir del ATP. Esto conduce a un aumento de la concentración intracelular del nucleótido cíclico.
La actividad estimulante de la GSα es autolimitada, ya que es una GPTasi, es decir, hidroliza el GTP unido a GDP, apagándose así. En su forma inactiva, la GSα se disocia de la adenil ciclasa y se vuelve a asociar con el dímero Gβγ. Por lo tanto, el heterotrímero vuelve a estar disponible para interactuar con un complejo hormona-receptor.
Proteína quinasa A
El AMPc se une y activa la proteína quinasa dependiente de AMPc o proteína quinasa A o PKA (EC 2.7.11.11). La forma inactiva de la enzima es un tetrámero compuesto por dos subunidades catalíticas y dos subunidades reguladoras. Cada una de las dos subunidades reguladoras tiene un dominio autoinhibitorio, es decir, una región que ocupa el sitio de unión para el sustrato de cada subunidad catalítica. La unión de dos moléculas de AMPc a dos sitios de cada subunidad reguladora conduce a un cambio conformacional que provoca su disociación del tetrámero, liberando las dos subunidades catalíticas como enzimas activas. La forma activa de la PKA cataliza la fosforilación de algunas proteínas, activándolas o inhibiéndolas, como:
El AMPc tiene una vida media muy corta: se hidroliza a AMP, que no tiene actividad de segundo mensajero, en la reacción catalizada por la nucleótido cíclico fosfodiesterasa (EC 3.1.4.53). La cafeína y la teofilina, dos metilxantinas contenidas en el café y el té, respectivamente, inhiben la fosfodiesterasa, aumentando así la vida media del AMPc, y potenciando sus efectos.
Fosforilasa quinasa
El siguiente paso en la cascada es catalizado por la fosforilasa quinasa.
La proteína está formada por cuatro subunidades diferentes, cada una presente con cuatro copias para formar un complejo denominado (αβγδ)4. Las subunidades γ tienen actividad catalítica, mientras que las α, β y δ son subunidades reguladoras. Las subunidades α y β se fosforilan cuando la enzima pasa del estado inactivo al activo. La subunidad δ, también llamada calmodulina, es una proteína reguladora que se une a los iones de calcio. Esta proteína también está presente en un gran número de otras enzimas. Actúa como un sensor de calcio, es decir, responde a los cambios en la concentración de calcio intracelular, influyendo en la actividad de las proteínas con las que interactúa (véase más adelante). La fosforilasa quinasa existe en dos isoformas, una expresada en el hígado y la otra en el músculo esquelético y cardíaco; difieren en cuanto a las subunidades α y γ, que están codificadas por genes diferentes.
Una de las proteínas diana de la fosforilasa quinasa es la glucógeno fosforilasa. Esta enzima existe como isoenzimas en diferentes tejidos, y en dos estados conformacionales en equilibrio dinámico, denominados:
La quinasa fosforila un único residuo de serina (Ser-14) en cada una de las dos subunidades de la glucógeno fosforilasa, que se encuentra casi en su totalidad en el estado T, convirtiéndola en la forma activa, que, por el contrario, se encuentra casi en su totalidad en el estado R, y desencadenando, por tanto, la descomposición del glucógeno.
La enzima fosforilada es la forma más activa de la enzima y se denomina glucógeno fosforilasa a; la enzima no fosforilada es la forma menos activa de la enzima y se denomina glucógeno fosforilasa b. Las dos formas enzimáticas pueden inhibirse o activarse de forma alostérica (véase más adelante).
En el músculo, la glucogenólisis libera glucosa 1-fosfato que, como se ha visto anteriormente, se metaboliza en el propio músculo para producir energía para la contracción muscular y, por tanto, para la respuesta de lucha o huida desencadenada por la adrenalina.
En el hígado, el glucagón desencadena la liberación de glucosa en la circulación para contrarrestar la hipoglucemia.
Una vez finalizada la situación de estrés, la fosforilasa a, también llamada fosfoproteína fosfatasa 1 o PP1 (EC 3.1.3.17), cataliza la eliminación de los grupos fosfato de la fosforilasa quinasa y de la glucógeno fosforilasa a, convirtiéndolas así en formas inactivas (la enzima elimina también los grupos fosfato de la glucógeno sintasa). La PP1 está formada por una subunidad catalítica, que tiene una baja eficiencia catalítica y una baja afinidad por el glucógeno, y la mencionada subunidad G, que pertenece a una familia de proteínas que se unen a otras proteínas al glucógeno, conocidas como proteínas de orientación al glucógeno (también la fosforilasa quinasa, la glucógeno fosforilasa y la glucógeno sintasa están unidas a partículas de glucógeno por proteínas de esta familia).
La PP1 también es inhibida por otra proteína llamada inhibidor 1 de la PP1.
Como se ha visto anteriormente, la PKA fosforila:
Por tanto, la unión de la hormona a su receptor desencadena una reacción en cascada que, entre otras cosas, conduce a la inhibición de la actividad de la PP1. Esto mantiene fosforiladas tanto la glucógeno fosforilasa como la glucógeno sintasa: la primera enzima se activa mientras que la segunda se inhibe. De este modo, se optimiza el metabolismo de los hidratos de carbono.
Regulación alostérica de la glucogenólisis en músculo e hígado
La glucogenólisis también está regulada por efectores alostéricos positivos y negativos. Estos actúan sobre tres enzimas: la fosforilasa quinasa muscular, la fosforilasa de glucógeno hepática y muscular, y la PP1.
La fosforilasa quinasa muscular
La actividad de la enzima está regulada por dos efectores alostéricos positivos, el ion calcio y el AMP, y un efector alostérico negativo, el ATP.
Un aumento de la concentración intracelular de iones de calcio es la señal para la contracción muscular y, una vez liberado del retículo sarcoplásmico, el calcio se une a la subunidad δ (calmodulina) de la enzima, activándola.
El AMP se acumula en el músculo durante la contracción intensa, debido al consumo de ATP, y se une a la enzima y la activa. Por el contrario, cuando la concentración de ATP es alta, es decir, el músculo no se contrae, se une al sitio alostérico del AMP inactivando la quinasa.
Fosforilasa quinasa hepática
Algunas hormonas pueden actuar tanto desencadenando modificaciones covalentes de las proteínas diana como provocando la liberación de iones de calcio del retículo endoplásmico.
En el hígado, la fosforilasa quinasa está regulada por hormonas que provocan la liberación de iones de calcio. Algunos ejemplos son la vasopresina, pero también la adrenalina cuando se une a los receptores α1. Con respecto a la adrenalina, su unión a los receptores α1 activa una proteína G que estimula la fosfolipasa C-β, que a su vez convierte el fosfatidilinositol-4,5-bifosfato en inositol 1,4,5-trifosfato (IP3) y diacilglicerol. El inositol 1,4,5-trifosfato provoca la liberación de iones de calcio del retículo endoplásmico. Los iones de calcio, uniéndose a la subunidad δ de la fosforilasa quinasa, conducen a su activación.
La glucógeno fosforilasa muscular
La glucógeno fosforilasa muscular b se activa en presencia de altas concentraciones de AMP, que, uniéndose a un sitio específico de unión de nucleótidos, cambia la estructura cuaternaria de la enzima, desplazando el equilibrio alostérico hacia el estado R activo de la forma b. Por el contrario, el ATP y la glucosa-6-fosfato, que compiten con el AMP por el mismo sitio de unión de nucleótidos, actúan como efectores alostéricos negativos, desplazando el equilibrio alostérico hacia el estado T inactivo de la forma b.
La glucógeno fosforilasa muscular a está activa, independientemente de los niveles de AMP, ATP y glucosa-6-fosfato.
En el músculo en reposo, casi toda la glucógeno fosforilasa está en la forma b inactiva.
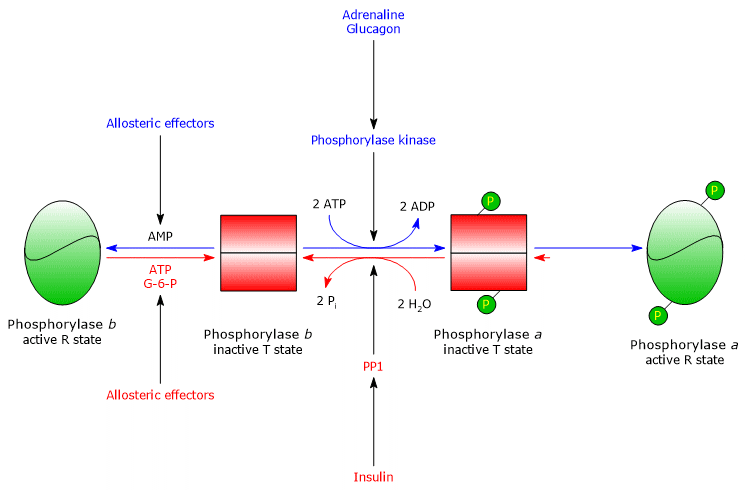
De hecho, la regulación covalente y alostérica de la enzima asegura que los niveles de glucosa intracelular estén finamente regulados.
Regulación alostérica de la PP1
La PP1 es activada alostéricamente por la glucosa-6-fosfato, por tanto, cuando la carga energética celular es baja.
Glucógeno fosforilasa hepática
En el hígado, la regulación alostérica de la enzima se produce a través de diferentes mecanismos.
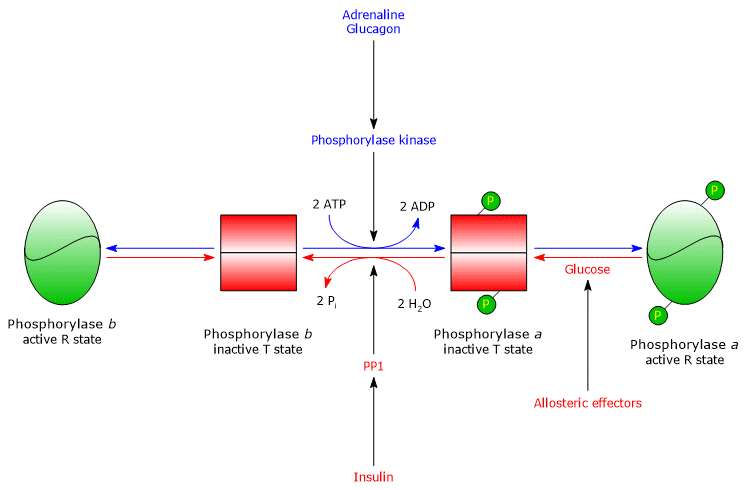
En el hígado, el propósito de la glucogenólisis es proporcionar glucosa a otros tejidos cuando el nivel de glucosa en sangre es bajo. Cuando el nivel de glucosa en sangre vuelve a ser normal, su concentración en los hepatocitos aumenta y se une a la glucógeno fosforilasa a, induciendo un cambio conformacional que expone los residuos de serina fosforilados a la actividad de la PP1, que inactiva la enzima por desfosforilación. Por lo tanto, el sitio alostérico para la glucosa de la glucógeno fosforilasa hepática permite que la enzima actúe como un sensor de glucosa en sangre, respondiendo adecuadamente a los cambios en el nivel de glucosa en sangre. En definitiva, la isoenzima hepática responde sólo a la glucosa, no al AMP, es decir, a la carga energética celular, y esto es digno de mención porque los ácidos grasos, y no la glucosa, son la principal fuente de energía para el hígado.
Berg J.M., Tymoczko J.L., y Stryer L. Biochemistry. 5th edition. W. H. Freeman and Company, 2002
Nelson D.L., M. Cox M.M. Lehninger. Principios de bioquímica. 4th Ed. W.H. Freeman and Company, 2004
Rawn J.D. Biochimica. Mc Graw-Hill, Neil Patterson Publishers, 1990
Roach P.J., Depaoli-Roach A.A., Hurley T.D., Tagliabracci V.S. Glycogen and its metabolism: some new developments and old themes. Biochem J 2012:441;763-87. doi:10.1042/BJ20111416
Rosenthal M.D., Glew R.H. Medical Biochemistry – Human Metabolism in Health and Disease. John Wiley J. & Sons, Inc., Publicación, 2009