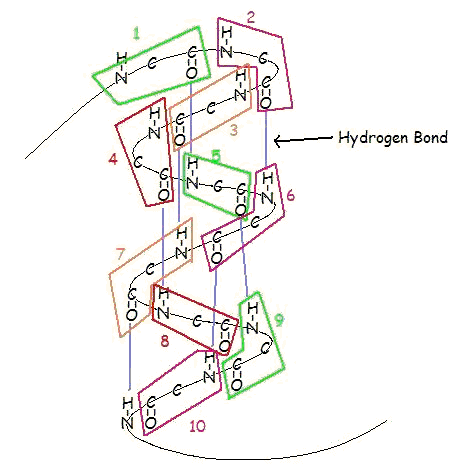
Una α-hélice es una bobina de residuos de aminoácidos en una cadena polipeptídica, que suele tener entre 4 y 40 residuos. Esta espiral se mantiene unida mediante enlaces de hidrógeno entre el oxígeno del C=O de la espiral superior y el hidrógeno del N-H de la espiral inferior. Este enlace de hidrógeno se forma exactamente cada 4 residuos de aminoácidos, y cada vuelta completa de la hélice es de sólo 3,6 residuos de aminoácidos. Este patrón regular confiere a la α-hélice unas características muy definidas en cuanto al grosor de la espiral y la longitud de cada vuelta completa a lo largo del eje de la hélice.
La integridad estructural de una α-hélice depende en parte de una correcta configuración estérica. Los aminoácidos cuyos grupos R son demasiado grandes (triptófano, tirosina) o demasiado pequeños (glicina) desestabilizan las α-hélices. La prolina también desestabiliza las α-hélices debido a su geometría irregular; su grupo R se une al nitrógeno del grupo amida, lo que provoca un impedimento estérico. Además, la falta de un hidrógeno en el nitrógeno de la prolina impide que participe en el enlace de hidrógeno.
Otro factor que afecta a la estabilidad de la hélice α es el momento dipolar total de toda la hélice debido a los dipolos individuales de los grupos C=O que participan en el enlace de hidrógeno. Las α-hélices estables suelen terminar con un aminoácido cargado para neutralizar el momento dipolar.