
Una hembra de pulpo gigante del Pacífico Norte (Enteroctopus dofleini) vive de tres a cuatro años; pone miles de huevos en un solo combate y luego muere. En cambio, una secuoya costera madura (Sequoia sempervirens) vive muchos cientos de años y produce millones de semillas cada año (Figura 1). Como ilustran estos dos ejemplos, los organismos difieren enormemente en su desarrollo, el tiempo que tardan en crecer, cuándo alcanzan la madurez, cuántas crías de un tamaño determinado producen y cuánto tiempo viven. En conjunto, los patrones de desarrollo, crecimiento, maduración, reproducción, supervivencia y vida útil específicos para cada edad, tamaño o etapa definen el ciclo vital de un organismo, su historia de vida.

El principal objetivo de la teoría de la historia de la vida, una rama de la ecología evolutiva, es explicar la notable diversidad de historias de vida entre las especies. Pero hay otra razón más convincente por la que la evolución de la historia de la vida es importante: la adaptación por selección natural se basa en la variación de la aptitud darwiniana entre los individuos, y dado que los rasgos de la historia de la vida determinan la supervivencia y la reproducción, son los principales componentes de la aptitud. El estudio de la evolución de la historia de la vida consiste, por tanto, en comprender la adaptación, la cuestión más fundamental de la biología evolutiva.
Aquí presentamos los fundamentos de la teoría de la historia de la vida y repasamos lo que los biólogos han aprendido sobre la evolución de la historia de la vida. Para una cobertura más profunda nos referimos a Stearns (1992), Roff (1992, 2002), Charlesworth (1994), y Flatt y Heyland (2011). Véase también los artículos de Nature Education Knowledge de Shefferson (2010), Young (2010), y Fabian y Flatt (2011).
Los fundamentos de la teoría de la historia de la vida
La teoría de la historia de la vida trata de explicar cómo la selección natural y otras fuerzas evolutivas dan forma a los organismos para optimizar su supervivencia y reproducción ante los retos ecológicos que plantea el entorno (Stearns 1992, Roff 1992, Stearns 2000), o como ha dicho recientemente David Reznick: «La teoría de la historia de la vida predice cómo la selección natural debería moldear la forma en que los organismos reparten sus recursos para hacer bebés» (Reznick 2010, p. 124). La teoría lo hace analizando la evolución de los componentes de la aptitud, los llamados rasgos de la historia de la vida, y cómo interactúan: el tamaño al nacer; el patrón de crecimiento; la edad y el tamaño en la madurez; el número, el tamaño y el sexo de la descendencia; el esfuerzo reproductivo específico por edad, etapa o tamaño; las tasas de supervivencia específicas por edad, etapa o tamaño; y la duración de la vida.
La teoría clásica trata la evolución de la historia de la vida como un problema de optimización: dados los factores ecológicos particulares (por ejemplo, los depredadores, la nutrición) que afectan a la probabilidad de supervivencia y reproducción de un organismo, y dadas las limitaciones y compensaciones intrínsecas al organismo, ¿cuáles son los valores y combinaciones óptimas de los rasgos de la historia de la vida que maximizan el éxito reproductivo? Para encontrar la solución a este problema necesitamos entender sus «condiciones límite» (Stearns 2000): (1) cómo los factores ambientales extrínsecos afectan a la supervivencia y la reproducción; y (2) cómo las conexiones intrínsecas entre los rasgos del ciclo vital (compensaciones) y otras restricciones limitan si los rasgos del ciclo vital pueden evolucionar y cómo. Una vez comprendidas y definidas estas condiciones, los modelos de ciclo vital pueden utilizarse para responder a preguntas como: ¿Cómo de pequeño o grande debe crecer un organismo? ¿A qué edad y tamaño debe madurar? ¿Cuántas veces debe reproducirse? ¿Cuántas crías debe producir y de qué tamaño? Durante cuánto tiempo debería reproducirse y cuánto tiempo debería vivir?
Los problemas de optimización de la historia de vida se modelan típicamente utilizando la ecuación de Euler-Lotka, que describe la tasa de crecimiento de la población (es decir, aptitud) de un genotipo clonal (o sustitución alélica) en tiempo generacional continuo como una función de su edad en la madurez, la edad en la última reproducción, la probabilidad de supervivencia por edad y el número esperado de descendientes por edad (Stearns 1992, Roff, 1992, Brommer 2000):
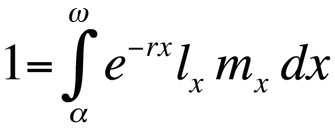
Donde α es la edad a la primera reproducción, ω la edad a la última reproducción, lx la probabilidad de sobrevivir desde el nacimiento hasta la clase de edad x, mx el número esperado de crías en la clase de edad x, y r la tasa de crecimiento de la población o parámetro maltusiano. La ecuación suma las probabilidades de supervivencia y reproducción a lo largo de toda la vida de los individuos de la población y, a continuación, puede resolverse para r. Obsérvese que, en el contexto de la teoría del ciclo vital, r mide la tasa de crecimiento o la aptitud de un clon o, en los organismos que se reproducen sexualmente, la tasa de propagación de un alelo que afecta al ciclo vital. Por tanto, el supuesto implícito es que la población modelada está formada por individuos fenotípica y genéticamente idénticos. Si la población descrita por la ecuación de Euler-Lotka es estacionaria (no crece), r es cero y la ecuación se convierte en
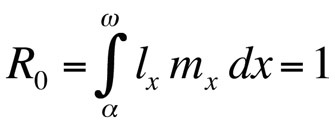
o, si el tiempo de generación es discreto,
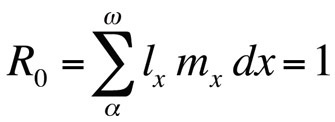
Donde R0 es el número esperado de hijas por hembra durante su vida (tasa neta de reproducción). Esta ecuación es más sencilla que la versión de tiempo continuo y puede utilizarse siempre que r sea cero o se acerque a cero; para poblaciones estables que no cambian de tamaño, R0 es la medida de aptitud adecuada (Stearns 1992, Roff 1992, Brommer 2000). Utilizando este marco, se puede preguntar qué combinación concreta de rasgos del ciclo vital maximiza la aptitud, o en qué medida se ve afectada la aptitud cuando se cambia uno de los rasgos. Este enfoque se ha utilizado con gran éxito para predecir la evolución de los rasgos del ciclo vital.
Variación genética de los rasgos del ciclo vital
La evolución de los rasgos del ciclo vital por selección natural depende de la variación genética sobre la que la selección puede actuar para producir adaptaciones en respuesta al medio ambiente. Los modelos mencionados anteriormente asumen implícitamente que la evolución del ciclo vital no está limitada por la falta de variación genética. Sin embargo, resulta interesante que la heredabilidad (h2 = VA/VP = varianza genética aditiva dividida por la varianza fenotípica), es decir, la proporción de las diferencias fenotípicas entre los individuos de una población que se explica por las diferencias genéticas aditivas entre ellos, suele ser pequeña para los rasgos del ciclo vital. Esta baja heredabilidad podría deberse a la baja cantidad de varianza genética aditiva; sin embargo, existe una amplia variación genética para los rasgos del ciclo vital en poblaciones naturales y de laboratorio. En consonancia con la noción de que los componentes de aptitud albergan mucha variación genética, muchos experimentos de selección artificial en el laboratorio han conseguido provocar cambios evolutivos en los rasgos del ciclo vital en la dirección prevista (Stearns 1992, Roff 1992, Houle 2001). Una de las razones de la gran VA de los rasgos de historia vital puede ser que se trata de rasgos altamente complejos, cuantitativos y poligénicos influidos por muchos loci (Houle 1992).
¿Pero cómo podemos conciliar el hecho de que el VA sea grande y al mismo tiempo h2 sea pequeño? Una razón probable para la baja heredabilidad de los rasgos de historia de vida es que, aunque el VA (el numerador) es grande, el VP (el denominador) es mucho mayor que el VA. Obsérvese que la varianza fenotípica VP consiste en VA, la varianza genética aditiva, más un resto, VR, que a su vez consiste en todas las fuentes genéticas no aditivas de variación (es decir, debidas a la dominancia, epistasis, etc.) y la variación fenotípica engendrada por el entorno (es decir, la plasticidad fenotípica, las interacciones genotipo-entorno; véase más adelante). Por lo tanto, los rasgos de historia de vida probablemente tienen una baja heredabilidad porque están influenciados por muchos loci (lo que infla tanto el VA como el VP) mientras que al mismo tiempo albergan cantidades sustanciales de variación residual VR, por ejemplo la variación debida a los cambios en el medio ambiente (que infla el VP pero no el VA) (Houle 1992, Houle 2001).
Además, aunque los rasgos del ciclo vital están sometidos a una fuerte selección, que debería agotar la varianza genética, hay varios factores que pueden mantener la variación genética de estos rasgos, como el equilibrio mutación-selección, la heterogeneidad ambiental y las interacciones genotipo-ambiente, y las correlaciones genéticas negativas (Stearns 1992, Roff 1992, Houle 2001). Sin embargo, a pesar de las grandes cantidades de variación en la historia de la vida, la evolución de la historia de la vida también está sujeta a restricciones.
Compensaciones del ciclo vital y otras limitaciones
La aptitud sería obviamente máxima si la supervivencia y la reproducción fueran máximas en todas las edades, etapas o tamaños de un organismo. En principio, entonces, el problema básico de la evolución de la historia de la vida es trivial: todos los rasgos de la historia de la vida deberían evolucionar siempre para maximizar la supervivencia y la reproducción y, por tanto, la aptitud (Houle 2001). Esto llevaría muy rápidamente a la evolución de «demonios darwinianos» (Law 1979) que se apoderarían del mundo, es decir, organismos que empiezan a reproducirse nada más nacer, producen un número infinito de descendientes y viven para siempre. Sin embargo, estos organismos no existen en el mundo real: Los recursos son finitos y los rasgos de la historia de la vida están sujetos a compensaciones intrínsecas y a otros tipos de restricciones, por lo que la selección natural no puede maximizar los rasgos de la historia de la vida -y por tanto la aptitud- más allá de ciertos límites. Llamamos a estos límites restricciones evolutivas (Stearns 1992, Houle 2001); como se mencionó anteriormente, representan la «condición límite» intrínseca que debemos entender para predecir la evolución de la historia de la vida.
Uno de los tipos más importantes de restricción son las compensaciones de la historia de la vida (Stearns 1992, Roff 1992, Flatt y Heyland 2011). Existe un trade-off cuando un aumento en un rasgo del ciclo vital (que mejora la aptitud) va unido a una disminución de otro rasgo del ciclo vital (que reduce la aptitud), de modo que el beneficio de la aptitud mediante el aumento del rasgo 1 se equilibra con un coste de la aptitud mediante la disminución del rasgo 2 (Figura 2A). A nivel genético, se cree que estas compensaciones son causadas por alelos con efectos pleiotrópicos antagónicos o por el desequilibrio de enlaces entre loci.
Las compensaciones se describen típicamente por correlaciones fenotípicas o genéticas negativas entre los componentes de la aptitud entre los individuos de una población (Figura 2A). Si la relación es genética, se predice que una correlación genética negativa limita (es decir, frena o impide) la evolución de los rasgos implicados. Por tanto, existe una compensación genética en una población cuando un cambio evolutivo en un rasgo que aumenta la aptitud está vinculado a un cambio evolutivo en otro rasgo que disminuye la aptitud. La existencia de correlaciones genéticas puede establecerse mediante diseños de cría genética cuantitativa o mediante respuestas fenotípicas correlacionadas a la selección. Por ejemplo, la selección artificial directa para la prolongación de la vida en poblaciones de laboratorio genéticamente variables de moscas de la fruta (Drosophila melanogaster) provoca la evolución de una mayor vida adulta (a veces en 10 o menos generaciones), pero este aumento evolutivo de la longevidad va unido a una disminución de la reproducción temprana (por ejemplo, Zwaan et al. 1995). Esto sugiere que la duración de la vida y la reproducción temprana están acopladas genéticamente de forma negativa, por ejemplo, a través de alelos pleiotrópicos antagónicos (por ejemplo, Flatt 2011, Fabian y Flatt 2011).
A nivel fisiológico, las compensaciones son causadas por la asignación competitiva de recursos limitados a un rasgo de la historia de la vida frente al otro dentro de un mismo individuo, por ejemplo, cuando los individuos con un mayor esfuerzo reproductivo tienen una menor duración de la vida o viceversa (Figura 2B). Una forma útil de pensar en las compensaciones en la asignación de recursos es imaginar que la historia de la vida es un pastel finito, en el que los diferentes trozos representan cómo un organismo divide sus recursos entre el crecimiento, el almacenamiento, el mantenimiento, la supervivencia y la reproducción (Reznick 2010; Figura 2C). El problema esencial es el siguiente: dadas las circunstancias ecológicas, y el hecho de que hacer una porción más grande significa hacer otra más pequeña, ¿cuál es la mejor manera de dividir el pastel? Hay que tener en cuenta que, dado que las compensaciones en la asignación de recursos pueden tener una base genética, y que diferentes genotipos pueden diferir en aspectos de la asignación de recursos, los puntos de vista genético y fisiológico de las compensaciones no son necesariamente incompatibles. Sin embargo, las compensaciones fisiológicas a nivel individual no siempre se traducen en compensaciones genéticas (evolutivas) a nivel poblacional. Por ejemplo, cuando la compensación fisiológica (dentro del individuo) está genéticamente fijada («cableada») entre todos los individuos dentro de la población, todos los individuos mostrarán la misma relación fisiológica negativa entre dos rasgos del ciclo vital, pero la correlación genética entre los individuos sería cero (Stearns 1989, Stearns 1992).
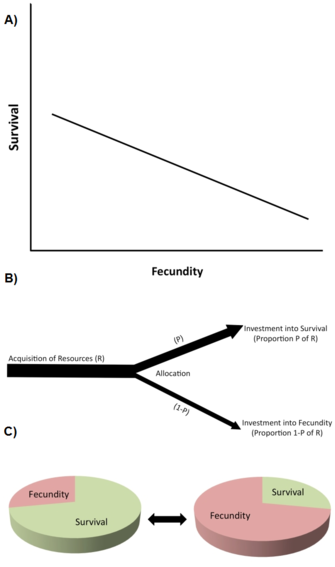
El libro de Stearns (1992) enumera 45 posibles compensaciones entre 10 rasgos principales de la historia de la vida, y se puede prever la existencia de muchos más. Las compensaciones que han recibido más atención incluyen (1) la reproducción actual frente a la supervivencia; (2) la reproducción actual frente a la futura; (3) la reproducción actual frente al crecimiento de los padres; (4) la reproducción actual frente a la condición de los padres; y (5) el número frente al tamaño de las crías.
Algunas de las mejores pruebas de las compensaciones de la historia de la vida con base genética provienen de la selección artificial y de los experimentos de evolución experimental llevados a cabo en Drosophila (ver revisiones en Stearns y Partridge 2001, Flatt y Schmidt 2009, Flatt 2011). En resumen, muchos experimentos han encontrado: una correlación negativa entre la fecundidad temprana y la vida adulta; una correlación positiva entre el tiempo de desarrollo y el tamaño corporal; una correlación positiva entre el tiempo de desarrollo o el tamaño corporal con la fecundidad temprana; y una correlación negativa entre la fecundidad temprana y la tardía.
Otras limitaciones en las historias de vida que impiden que la selección natural alcance un óptimo de aptitud particular pueden implicar factores biofísicos, bioquímicos y estructurales, propiedades de desarrollo del organismo, contingencias filogenéticas e históricas, o simplemente una falta de variación genética (Stearns 1992, Houle 2001).
Plasticidad fenotípica en los rasgos de historia de vida
La variación genética y las limitaciones no son los únicos factores que afectan a la expresión y evolución de los rasgos de historia de vida. Otra cuestión importante es que la variación del ciclo vital suele estar fuertemente influenciada por el medio ambiente (por ejemplo, la temperatura, la nutrición, los depredadores,), un fenómeno llamado plasticidad fenotípica, es decir, la capacidad de un único genotipo (o clon) para producir diferentes fenotipos en diferentes entornos (Stearns 1992, Roff 1997, Pigliucci 2001, DeWitt y Scheiner 2004). La plasticidad de un genotipo específico puede describirse conceptualmente mediante una función matemática denominada norma de reacción, es decir, una línea o curva que relaciona los fenotipos producidos por este genotipo con los cambios en el entorno que experimenta (Figura 3A).
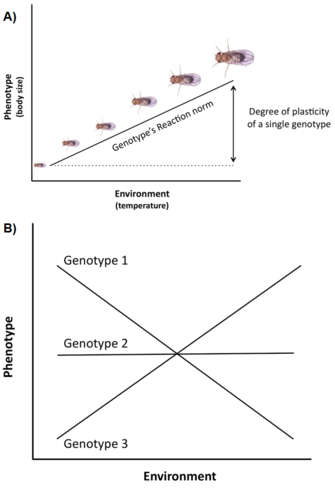
La importancia de dicha plasticidad en la evolución de la historia de la vida es al menos triple (Stearns y Koella 1986, Stearns et al. 1991, Stearns 1992, Nylin y Gotthard 1998, DeWitt y Scheiner 2004, Flatt 2005): (1) dado que la plasticidad modula la expresión fenotípica de la variación genética para los rasgos individuales del ciclo vital y de las correlaciones genéticas para los pares de rasgos, afecta a la respuesta genética a la selección a través de los entornos; (2) si existe una variación adaptativa entre los genotipos para la respuesta plástica, la selección puede producir una norma de reacción óptima que maximice la aptitud a través de los entornos; y (3) la plasticidad de un rasgo específico puede amortiguar homeostáticamente al organismo frente a los cambios inducidos por el entorno en otros rasgos, de modo que se optimice el rendimiento del organismo y, por tanto, la aptitud.
Muchos rasgos de la historia de la vida (por ejemplo, edad en la madurez, fecundidad) muestran un alto grado de plasticidad, y a menudo hay una variación genética significativa para la plasticidad en las poblaciones naturales, es decir, los genotipos tienen diferentes normas de reacción, un fenómeno llamado interacción genotipo por ambiente (GxE) (Figura 3B). Además, no sólo los rasgos individuales, sino también las correlaciones entre rasgos pueden ser plásticas, y diferentes entornos pueden cambiar la pendiente y/o el signo de la correlación de rasgos (Stearns et al. 1991, Stearns 1992). En los sapos de espuelas (Scaphiophus couchii), por ejemplo, los individuos que se desarrollan en estanques de corta duración tienen un periodo larvario más corto y un tamaño corporal más pequeño en la metamorfosis (estando los rasgos correlacionados negativamente) que los individuos que se desarrollan en estanques de larga duración (estando los rasgos correlacionados positivamente) (Newman 1988, Stearns et al. 1991).
Habiendo discutido el enfoque del modelo de optimalidad y los factores que influyen en la expresión de los rasgos del ciclo vital, pasamos ahora a discutir algunas de las principales predicciones para la evolución de los ciclos vitales (para más detalles ver Stearns 1992, Roff 1992, Charlesworth 1994, Stearns 2000, Roff 2002).
Predicciones para la evolución de los rasgos del ciclo vital
¿A qué edad y tamaño debe madurar un organismo? El éxito reproductivo de un genotipo depende en gran medida de su tasa de crecimiento y -como consecuencia del crecimiento- de su edad y tamaño en la madurez. Para predecir la edad y el tamaño óptimos en la madurez, debemos comprender los costes y beneficios relativos (en términos de mortalidad y reproducción) de madurar pronto o tarde y de crecer o quedarse pequeño. Los beneficios de una «estrategia» son los costes de la otra, y viceversa. Los beneficios de madurar antes y con un tamaño menor (es decir, los costes de madurar más tarde y con un tamaño mayor) incluyen (1) una mayor probabilidad de supervivencia hasta la madurez debido a una menor duración del arriesgado periodo de desarrollo y juvenil, y (2) un menor tiempo de generación que permite a los padres producir crías que nacen antes y que comienzan a reproducirse antes. Así, una elevada mortalidad juvenil, por ejemplo, debería favorecer la evolución de una maduración más temprana. Por el contrario, los beneficios de madurar más tarde y con un tamaño mayor (es decir, los costes de madurar antes y con un tamaño menor) incluyen (1) un crecimiento más prolongado que conduce a un mayor tamaño en la madurez y, por tanto, a un aumento de la fecundidad (ya que la fecundidad suele aumentar con el tamaño), (2) una menor mortalidad adulta (y, por tanto, una fecundidad potencialmente mayor a lo largo de la vida) debido a un mayor tamaño (la mortalidad debida a los depredadores suele ser menor en los individuos más grandes), y (3) una descendencia de mayor calidad (por ejemplo, una mayor inversión por cría, un mejor cuidado parental) que mejora la supervivencia de las crías producidas.
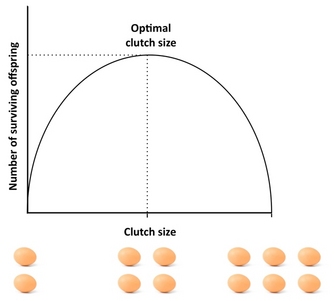
¿Cuánta descendencia debe producir un organismo? Un buen punto de partida para abordar esta cuestión es la «puesta de Lack», un concepto que se remonta al ornitólogo David Lack (1947). La idea básica de Lack era que las aves debían optimizar el tamaño de sus puestas maximizando el número de crías emplumadas (supervivientes). Las desviaciones de este tamaño óptimo de la puesta reducirían el éxito reproductivo: si los padres producen una puesta demasiado grande, es posible que no puedan mantener y criar a todas sus crías, muriendo algunas o todas ellas, mientras que si producen una puesta demasiado pequeña, el número de crías voladas puede ser inferior al que los padres podrían mantener (Figura 4). Aunque Lack tenía razón en su afirmación de que la aptitud suele maximizarse con una inversión intermedia, el tamaño de las puestas suele ser menor de lo que predice el concepto de Lack. Esto se debe a que el concepto ignora varios factores que pueden reducir el tamaño de la puesta, como la mortalidad de los padres, la reproducción futura, la tasa de producción de los nietos y el conflicto entre padres y crías. Por ejemplo, la existencia de compensaciones entre la reproducción actual y la supervivencia de los padres, la reproducción actual y la futura, o el número y el tamaño de las crías pueden causar desviaciones de la puesta Lack, y los modelos que tienen en cuenta estos factores suelen dar un mejor ajuste con el tamaño de la puesta observado que la puesta Lack. Para un excelente estudio empírico sobre el tamaño óptimo de la puesta, véase el estudio de Daan et al. (1990) sobre los cernícalos europeos.
¿Cada cuánto tiempo debe reproducirse un organismo? ¿Debería ser semélparo (es decir, reproducirse una sola vez) o iteróparo (es decir, reproducirse varias veces) (Figura 5; véase también Young 2010)? La teoría sugiere que la iteroparidad y la evolución del aumento de la vida reproductiva se ven favorecidas cuando la supervivencia de los adultos es alta y cuando la fecundidad de los adultos o la supervivencia de los jóvenes es baja: la supervivencia de los adultos alta (o no variable) aumenta el número de eventos reproductivos por vida, y la fecundidad baja (o variable) o la supervivencia de los jóvenes causan pérdidas de aptitud que seleccionan un mayor esfuerzo reproductivo compensatorio. Por el contrario, la semelparidad y la evolución de la disminución de la vida reproductiva se ven favorecidas cuando la supervivencia de los adultos es baja y la de los jóvenes es alta. Así, una supervivencia adulta alta (o no variable) en relación con la juvenil favorece la iteroparidad y alarga la vida reproductiva, mientras que una mortalidad adulta alta (o variable) en relación con la juvenil favorece la semelparidad y acorta la vida reproductiva. Los organismos semélparos suelen tener un mayor esfuerzo reproductivo que los iteróparos.

Las consideraciones anteriores son aspectos de una cuestión más general denominada «problema general de la historia de la vida» o «modelo de esfuerzo reproductivo» (Schaffer 1983, Stearns 1992, Roff 1992, Charlesworth 1994): dado que la reproducción tiene tanto beneficios (es decir, producción de crías) y costes (por ejemplo, disminución de la reproducción futura, aumento de la mortalidad de los padres o de las crías), ¿cuál es la inversión reproductiva óptima que maximiza la aptitud? Muchos estudios teóricos y empíricos han abordado este problema; algunas de las principales conclusiones de estos trabajos son (véase Stearns 1992, Roff 1992, Charlesworth 1994) (1) el esfuerzo reproductivo a menudo, pero no siempre, aumenta con la edad porque se espera que el coste de la reproducción actual en términos de reproducción futura disminuya con la edad (ya que el número de eventos reproductivos futuros en los que los costes pueden manifestarse disminuye con la edad); (2) si el esfuerzo reproductivo produce rendimientos decrecientes o si la mortalidad aumenta a medida que el esfuerzo aumenta, se favorece la inversión reproductiva intermedia y la iteroparidad; de lo contrario, se favorece el esfuerzo reproductivo máximo y la semiparidad; (3) si la mortalidad aumenta en todas las clases de edad, el esfuerzo reproductivo aumenta al principio de la vida y la edad de madurez disminuye; de forma similar, si la mortalidad de los adultos aumenta, la edad de madurez debería disminuir; y (4) si la mortalidad aumenta después de una edad concreta (o en una clase de edad específica), el esfuerzo reproductivo aumenta antes y disminuye después de esa edad. Como pruebas especialmente bellas de tales modelos de esfuerzo reproductivo remitimos al lector a los experimentos de campo y de laboratorio de David Reznick y sus colegas con guppys de Trinidad (por ejemplo, Reznick et al. 1990).
¿Cuánto debería vivir un organismo (véase también Fabian y Flatt 2011)? La evolución de la vida útil puede verse como un equilibrio entre la selección para aumentar la vida reproductiva (y, por lo tanto, potencialmente aumentar el éxito reproductivo) y el envejecimiento (es decir, el aumento intrínseco de la mortalidad dependiente de la edad). Los beneficios de la evolución de una vida reproductiva más larga incluyen (también ver arriba) (1) un mayor número de eventos reproductivos (y, por tanto, de crías) por vida si la mortalidad extrínseca de los adultos es baja, (2) tiempo suficiente para compensar reproductivamente las crías perdidas debido a la alta mortalidad juvenil, y (3) menor incertidumbre reproductiva debido a la alta variación de la mortalidad juvenil de una ronda de reproducción a la siguiente, de nuevo al poder compensar las crías perdidas. Estos efectos se ven contrarrestados por los que aumentan la mortalidad adulta (por ejemplo, los costes de supervivencia de la reproducción; el envejecimiento) en relación con la mortalidad juvenil. Así, los aumentos en la media (y/o la varianza) de la mortalidad adulta en relación con la juvenil tienden a favorecer una vida reproductiva más corta y la semelparidad, mientras que las disminuciones en la media (y/o la varianza) de la mortalidad adulta en relación con la juvenil tienden a favorecer una vida reproductiva más larga y la iteroparidad.
Hoy en día muchas de estas predicciones de la teoría de la historia de la vida están bien respaldadas por la evidencia; terminaremos este artículo dando un ejemplo de un experimento particularmente elegante que ha confirmado las principales predicciones del «problema general de la historia de la vida».
Un ejemplo de prueba empírica de la teoría
Para poner a prueba los principios básicos de la teoría del ciclo vital, Stearns et al. (2000) utilizaron una población de moscas de la fruta (D. melanogaster) para establecer dos conjuntos de líneas replicadas de «evolución experimental»: tres líneas fueron expuestas a un tratamiento de alta mortalidad adulta (HAM; matando al azar al 90% de las moscas dos veces por semana) y tres líneas a un tratamiento de baja mortalidad adulta (LAM; matando al 10% de las moscas dos veces por semana). Tras cuatro años de evolución experimental bajo estas condiciones en el laboratorio, Stearns y sus colaboradores midieron los fenotipos de la historia vital de todas las líneas en ambos tratamientos para examinar las respuestas evolutivas de las moscas a la alta mortalidad extrínseca frente a la baja. Los resultados de este experimento a largo plazo fueron tan claros como intrigantes, y confirmaron las predicciones teóricas: las moscas de la fruta que habían evolucionado en condiciones HAM se desarrollaron más rápidamente como larvas, eclosionaron antes y con un tamaño menor como adultas, tuvieron un pico de fecundidad más alto y mostraron una vida más corta que las moscas LAM, que evolucionaron con el conjunto opuesto de adaptaciones. En otras palabras, las moscas que evolucionaron en un entorno altamente peligroso respondieron evolutivamente acelerando su desarrollo, disminuyendo su edad y tamaño en la madurez, poniendo más huevos antes y viviendo menos tiempo: se adaptaron a los altos niveles de mortalidad aleatoria trasladando su esfuerzo reproductivo a edades más tempranas y comprimiendo toda su historia vital en una vida más corta. Así, de forma similar a los hallazgos de Reznick et al. (1990) en los guppys, estos resultados confirman las principales predicciones de la teoría de la historia de la vida, en particular el importante papel de la mortalidad extrínseca de los adultos en la configuración de la evolución del crecimiento, la maduración, la reproducción y el envejecimiento.
Resumen
Aquí hemos presentado los fundamentos de la teoría de la historia de la vida. La teoría de la historia de la vida intenta comprender cómo la selección natural diseña a los organismos para lograr el éxito reproductivo, dado el conocimiento de cómo los factores selectivos del entorno (es decir, la mortalidad extrínseca) y los factores intrínsecos al organismo (es decir, las compensaciones, las limitaciones) afectan a la supervivencia y la reproducción. Utilizando diversos métodos teóricos y empíricos, y en particular aplicando el pensamiento de optimización, los teóricos de la historia de la vida han derivado importantes predicciones sobre la evolución de los principales rasgos de la historia de la vida, como la edad y el tamaño en la madurez, el número y el tamaño de la descendencia, el esfuerzo reproductivo específico por edad o tamaño, la duración de la vida reproductiva y el envejecimiento. Basándose en estas predicciones, y poniéndolas a prueba en experimentos de campo y de laboratorio, por ejemplo en moscas, peces o aves, los biólogos de la historia vital nos han proporcionado algunas respuestas convincentes a preguntas fundamentales como: ¿A qué velocidad debe desarrollarse un organismo? ¿A qué edad y tamaño debe madurar? ¿Cuántas crías debe tener y de qué tamaño deben ser? ¿Debe reproducirse una o varias veces? ¿Y cuánto tiempo debe vivir? Al abordar estos problemas, la teoría de la historia de la vida ha tenido un gran impacto en nuestra comprensión de la adaptación por selección natural, la cuestión más fundamental de toda la biología evolutiva.