Todas las sales e iones que se disuelven en el agua de mar contribuyen a su salinidad global. La salinidad del agua de mar suele expresarse como los gramos de sal por kilogramo (1000 g) de agua de mar. Por término medio, hay unos 35 g de sal en cada 1 kg de agua de mar, por lo que decimos que la salinidad media del océano es de 35 partes por mil (ppt). Obsérvese que 35 ppt equivale al 3,5% (partes por cien). Algunas fuentes utilizan ahora unidades prácticas de salinidad (PSU) para expresar los valores de salinidad, donde 1 PSU = 1 ppt. Las unidades no se incluyen, por lo que podemos referirnos simplemente a una salinidad de 35.
En el océano se disuelven muchas sustancias diferentes, pero seis iones comprenden aproximadamente el 99,4% de todos los iones disueltos en el agua de mar. Estos seis iones principales son (Tabla 5.3.1):
Tabla 5.3.1 Los seis iones principales del agua de mar
| g/kg en agua de mar | % de iones en peso | |
|---|---|---|
| Cloruro Cl- | 19.35 | 55,07% |
| Sodio Na+ | 10,76 | 30,6% |
| Sulfato SO42- | 7.72% | |
| Magnesio Mg2+ | 1,29 | 3,68% | Calcio Ca2+ | 0,41 | 1,17% | Potasio K+ | 0,39 | 1.1% |

El cloruro y el sodio, componentes de la sal de mesa (cloruro de sodio NaCl), constituyen más del 85% de los iones del océano, razón por la cual el agua de mar tiene un sabor salado (figura 5.3.1). Además de los componentes principales, hay numerosos componentes menores: radionucleótidos, compuestos orgánicos, metales, etc. Estos componentes menores se encuentran en concentraciones de ppm (partes por millón) o ppb (partes por billón), a diferencia de los iones mayores que son mucho más abundantes (ppt) (Tabla 5.3.2). Para poner esto en perspectiva, 1 ppm = 1 mg/kg, o el equivalente a 1 cucharadita de azúcar disuelta en 14.000 latas de refresco. 1 ppb = 1 μg/kg, o el equivalente a 1 cucharadita de una sustancia disuelta en cinco piscinas olímpicas. Estos constituyentes menores representan numerosas sustancias, pero juntos constituyen menos del 1% de los iones del agua de mar. Algunos de ellos pueden ser importantes como minerales y oligoelementos vitales para los organismos vivos, pero no tienen mucho impacto en la salinidad general. Pero dado el gran tamaño de los océanos, incluso los materiales que se encuentran en abundancia de trazas pueden representar depósitos bastante grandes. Por ejemplo, el oro es un elemento traza en el agua de mar, que se encuentra en concentraciones de partes por trillón, y sin embargo, si se pudiera extraer todo el oro de un solo km3 de agua de mar, ¡tendría un valor de unos 20 millones de dólares!
Tabla 5.3.2 Concentraciones de algunos elementos menores en el agua de mar
| g/kg en agua de mar | g/kg en agua de mar | ||
|---|---|---|---|
| Carbono | 0.028 | Hierro | 2 x 10-6 |
| Nitrógeno | 0,0115 | Manganeso | 2 x 10-7 |
| Oxígeno | 0.006 | Cobre | 1 x 10-7 |
| Silicio | 0.002 | Mercurio | 3 x 10-8 |
| Fósforo | 6 x 10-5 | Oro | 4 x 10-9 |
| Uranio | 3.2 x 10-6 | Plomo | 5 x 10-10 |
| Aluminio | 2 x 10-6 | Radón | 6 x 10-19 |
Debido a que los seis iones principales del agua de mar comprenden más del 99% de la salinidad total, los cambios en la abundancia de los componentes menores tienen poco efecto en la salinidad total. Además, la regla de las proporciones constantes establece que, aunque la salinidad absoluta del agua del océano pueda variar en distintos lugares, las proporciones relativas de los seis iones principales dentro de esa agua son siempre constantes. Por ejemplo, independientemente de la salinidad total de una muestra de agua de mar, el 55% de la salinidad total se deberá al cloruro, el 30% al sodio, y así sucesivamente. Como la proporción de estos iones principales no cambia, los llamamos iones conservadores.
Dadas estas proporciones constantes, para calcular la salinidad total basta con medir la concentración de uno solo de los iones principales y utilizar ese valor para calcular el resto. Tradicionalmente, el cloruro ha sido el ion medido porque es el más abundante y, por tanto, el más sencillo de medir con precisión. Multiplicando la concentración de cloruro por 1,8 se obtiene la salinidad total. Por ejemplo, observando la figura 5.3.1, 19,25 g/kg (ppt) de cloruro x 1,8 = 35 ppt. Hoy en día, para realizar mediciones rápidas de la salinidad, se suele utilizar la conductividad eléctrica en lugar de determinar las concentraciones de cloruro (véase el recuadro siguiente).

Este instrumento mide el grado de curvatura, o refracción, de los rayos de luz al pasar por un fluido. Cuanto mayor sea la cantidad de sales disueltas en la muestra, mayor será el grado de refracción de la luz. El observador atrapa una gota de agua en la pantalla azul y mira a través del ocular. La línea divisoria entre las secciones azul y blanca de la escala (recuadro) puede utilizarse para leer la salinidad.
Para realizar mediciones más precisas, la mayoría de los oceanógrafos utilizan un instrumento que mide la conductividad eléctrica. Se hace pasar una corriente eléctrica entre dos electrodos sumergidos en el agua, y cuanto mayor sea la salinidad, más fácilmente se conducirá la corriente (los iones del agua de mar conducen las corrientes eléctricas). Las sondas de conductividad suelen estar agrupadas en un instrumento llamado CTD, que significa Conductividad, Temperatura y Profundidad, que son los parámetros que más se miden. Los CTD modernos pueden estar equipados con una serie de sondas que miden parámetros como la luz, la turbidez (claridad del agua), los gases disueltos, etc. Los CTD pueden ser instrumentos de gran tamaño (abajo), pero también hay disponibles pequeñas sondas de salinidad manuales.

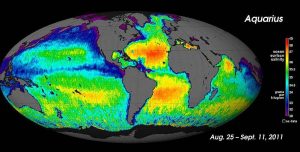
Para las mediciones de salinidad a gran escala, los oceanógrafos pueden utilizar satélites, como el satélite Aquarius, que fue capaz de medir diferencias de salinidad en la superficie tan pequeñas como 0,2 PSU mientras cartografiaba la superficie del océano cada siete días (abajo).
Es importante tener en cuenta que, aunque la regla de las proporciones constantes se aplica a la mayor parte del océano, puede haber ciertas zonas costeras en las que una gran cantidad de descargas fluviales puede alterar ligeramente estas proporciones. Además, es importante recordar que la regla de las proporciones constantes sólo se aplica a los iones mayores. Las proporciones de los iones menores pueden fluctuar, pero recuerde que su contribución a la salinidad global es muy pequeña. Debido a que las concentraciones de los iones menores no son constantes, estos se denominan iones no conservadores.
¿Por qué los iones mayores se encuentran en proporciones constantes? Hay una entrada constante de iones procedentes de la escorrentía de los ríos y de otros procesos, normalmente en proporciones muy diferentes a las que se encuentran en el océano. Entonces, ¿por qué no cambian las proporciones en los océanos? La mayoría de los iones vertidos por los ríos tienen tiempos de residencia bastante bajos (véase el apartado 5.2) en comparación con los iones del agua de mar, normalmente porque se utilizan en procesos biológicos. Estos bajos tiempos de residencia no permiten que los iones se acumulen y alteren la salinidad. Además, el tiempo de mezcla del océano mundial es de unos 1.000 años, que es muy corto comparado con los tiempos de residencia de los principales iones, que pueden ser de decenas de millones de años. Así que durante el tiempo de residencia de un solo ion el océano se ha mezclado numerosas veces, y los iones principales se han distribuido uniformemente por todo el océano.
Variaciones en la salinidad
La salinidad total en el océano abierto tiene una media de 33-37 ppt, pero puede variar significativamente en diferentes lugares. Pero como las proporciones de los iones principales son constantes, las diferencias regionales de salinidad deben deberse más a la entrada y eliminación de agua que a la adición o eliminación de iones. La entrada de agua dulce se produce a través de procesos como la precipitación, la escorrentía de la tierra y el deshielo. La eliminación de agua dulce procede principalmente de la evaporación y la congelación (cuando el agua de mar se congela, el hielo resultante es en su mayor parte agua dulce y las sales se excluyen, haciendo que el agua restante sea aún más salada). Por tanto, las diferencias en las tasas de precipitación, evaporación, descarga de los ríos y formación de hielo desempeñan un papel importante en las variaciones regionales de salinidad. Por ejemplo, el Mar Báltico tiene una salinidad superficial muy baja, de unos 10 ppt, porque es una masa de agua mayoritariamente cerrada con mucha aportación fluvial. Por el contrario, el Mar Rojo es muy salado (alrededor de 40 ppt), debido a la falta de precipitaciones y al ambiente caluroso que provoca altos niveles de evaporación.
Una de las grandes masas de agua más saladas de la Tierra es el Mar Muerto, entre Israel y Jordania. La salinidad del Mar Muerto es de unos 330 ppt, es decir, casi diez veces más salada que la del océano. Esta salinidad extremadamente alta es el resultado de las condiciones cálidas y áridas de Oriente Medio, que conducen a altas tasas de evaporación. Además, en la década de 1950 el caudal del río Jordán se desvió del Mar Muerto, por lo que ya no hay un aporte significativo de agua dulce. Al no haber aportes de agua y la alta evaporación, el nivel del Mar Muerto está bajando a un ritmo de 1 m por año. La alta salinidad hace que el agua sea muy densa, lo que crea fuerzas de flotación que permiten a las personas flotar fácilmente en la superficie. Pero la alta salinidad también significa que el agua es demasiado salada para la mayoría de los organismos vivos, por lo que sólo los microbios pueden llamarlo hogar; de ahí el nombre de Mar Muerto. Pero por muy salado que sea el Mar Muerto, no es la masa de agua más salada de la Tierra. Esa distinción corresponde actualmente al estanque de Gaet’ale, en Etiopía, con una salinidad de 433 ppt
Variaciones latitudinales
Aunque las condiciones locales son importantes para determinar los patrones de salinidad en cualquier lugar, hay algunos patrones globales que merecen una mayor investigación. La temperatura es más alta en el ecuador y más baja cerca de los polos, por lo que cabría esperar mayores tasas de evaporación y, por tanto, mayor salinidad, en las regiones ecuatoriales (Figura 5.3.2). En general, esto es así, pero en la figura siguiente la salinidad a lo largo del ecuador parece ser un poco más baja que en latitudes ligeramente superiores. Esto se debe a que las regiones ecuatoriales también reciben un gran volumen de lluvia de forma regular, lo que diluye el agua superficial a lo largo del ecuador. Por ello, las salinidades más altas se encuentran en latitudes subtropicales y cálidas, con una alta evaporación y menos precipitaciones. En los polos hay poca evaporación, lo que, unido a la fusión del hielo y la nieve, produce una salinidad superficial relativamente baja. La imagen de abajo muestra la alta salinidad del Mar Mediterráneo; éste se encuentra en una región cálida con alta evaporación, y el mar está en gran medida aislado de la mezcla con el resto del agua del Atlántico Norte, lo que provoca una alta salinidad. Las salinidades más bajas, como las que rodean el sudeste asiático, son el resultado de las precipitaciones y de los altos volúmenes de aportes fluviales.

La figura 5.3.3 muestra las diferencias medias globales entre la evaporación y la precipitación (evaporación – precipitación). Los colores verdes representan las zonas en las que las precipitaciones superan a la evaporación, mientras que las regiones marrones son aquellas en las que la evaporación es mayor que las precipitaciones. Obsérvese la correlación entre la precipitación, la evaporación y la salinidad de la superficie, como se observa en la figura 5.3.2.

Variación vertical
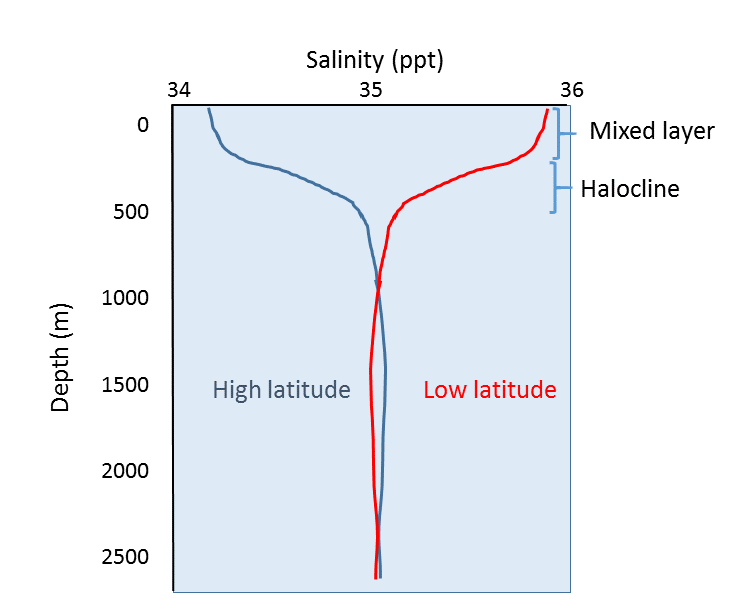
Además de la variación geográfica de la salinidad, también hay cambios en la salinidad con la profundidad. Como hemos visto, la mayoría de las diferencias en la salinidad se deben a las variaciones en la evaporación, la precipitación, la escorrentía y la capa de hielo. Todos estos procesos ocurren en la superficie del océano, no en la profundidad, por lo que las diferencias de salinidad más pronunciadas deberían encontrarse en las aguas superficiales. La salinidad en aguas más profundas permanece relativamente uniforme, ya que no se ve afectada por estos procesos superficiales. En la figura 5.3.4 se muestran algunos perfiles de salinidad representativos. En la superficie, los 200 m superiores aproximadamente muestran una salinidad relativamente uniforme en lo que se denomina la capa mixta. Los vientos, las olas y las corrientes superficiales agitan el agua de la superficie, lo que provoca una gran mezcla en esta capa y unas condiciones de salinidad bastante uniformes. Por debajo de la capa mixta hay una zona de rápido cambio de salinidad en un pequeño cambio de profundidad. Esta zona de cambio rápido se denomina haloclina y representa una transición entre la capa mixta y el océano profundo. Por debajo de la haloclina, la salinidad puede mostrar poca variación hasta el fondo marino, ya que esta región está muy alejada de los procesos superficiales que afectan a la salinidad. En la figura siguiente, obsérvese la baja salinidad de la superficie en las latitudes altas, y la mayor salinidad de la superficie en las latitudes bajas, como se ha comentado anteriormente. Sin embargo, a pesar de las diferencias superficiales, la salinidad en profundidad en ambos lugares puede ser muy similar.
Un átomo o molécula que ha ganado o perdido electrones y, por tanto, se ha cargado (5.1)
Concentración de iones disueltos en el agua (5.3)
Medida de salinidad sin unidades, igual a partes por mil (5.3)
Los seis iones que componen más del 99% de los iones del océano (cloruro, sodio, sulfato, magnesio, calcio, potasio) (5.3)
Los principales iones del agua de mar se encuentran siempre en las mismas proporciones, independientemente de la salinidad general (5.3)
Los iones principales en el agua de mar se encuentran siempre en las mismas proporciones, independientemente de la salinidad global; los iones principales en el agua de mar (5.3)
Los iones en el agua de mar cuyas proporciones fluctúan con los cambios de salinidad (5.3)
Flujo de agua por una pendiente, ya sea a través de la superficie del suelo, o dentro de una serie de canales (12.2)
La cantidad media de tiempo que un elemento permanecerá en el océano antes de ser eliminado (5.2)
Partes por mil
La distancia al norte o al sur del ecuador, medida como un ángulo desde el ecuador (2.1)
La capa superior del océano, donde los vientos, las olas y las corrientes mezclan el agua para que las condiciones sean relativamente constantes; aproximadamente los 100 m superiores (5.3)
Donde hay un cambio dramático en la salinidad sobre un pequeño cambio en la profundidad (5.3)