.jpg) La fabricación de amoníaco es crucial para la industria agrícola mundial, ya que a partir de él se producen todos los fertilizantes que contienen nitrógeno.
La fabricación de amoníaco es crucial para la industria agrícola mundial, ya que a partir de él se producen todos los fertilizantes que contienen nitrógeno.
Usos del amoníaco
La fabricación de fertilizantes es, con mucho, el uso más importante del amoníaco. Entre ellos se encuentran la urea, las sales de amonio (fosfatos de amonio, nitrato de amonio, nitrato de amonio de calcio) y las soluciones de amoníaco.
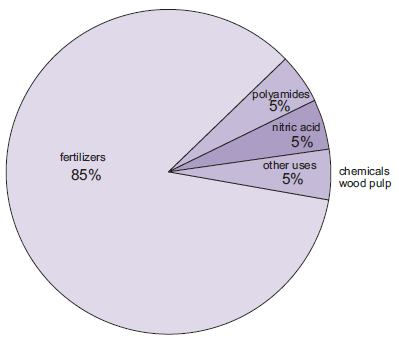
Figura 1 Los usos del amoníaco.
Una cantidad cada vez mayor de amoníaco, aunque todavía pequeña en comparación con otros usos, se utiliza como solución concentrada para combatir el vertido de óxidos de nitrógeno de las centrales eléctricas.
Producción anual de amoníaco
El amoníaco ocupa el segundo lugar, tras el ácido sulfúrico, como producto químico con mayor tonelaje. Se fabrica cada vez más en países que disponen de fuentes de gas natural y carbón de bajo coste (China y Rusia representan aproximadamente el 40%). Las plantas más grandes producen unas 3.000 toneladas al día y hay planes para construir plantas que produzcan entre 4.000 y 5.000 toneladas al día, lo que significaría que la producción mundial total podría gestionarse con 100 unidades de este tipo. La producción actual es:
| Mundial | 146 millones de toneladas |
| China | 48 millones de toneladas |
| Rusia | 12 millones de toneladas |
| India | 11 millones de toneladas |
| U.S. | 9 millones de toneladas | Indonesia | 5 millones de toneladas | Trinidad y Tobago | 5 millones de toneladas |
| Ucrania | 4 millones de toneladas |
Datos de:
U.S. Geological Survey, Mineral Commodity Summaries, 2016.
El aumento del tonelaje de amoníaco fabricado no hace más que seguir el ritmo de la creciente polulación mundial y de su creciente nivel de vida. Se espera que la demanda de amoníaco aumente hasta casi 200 millones de toneladas en 20181.
1. International Fertilizer Association, 2014.
Fabricación de amoníaco
La fabricación de amoníaco a partir de nitrógeno e hidrógeno tiene lugar en dos etapas principales:
a) la fabricación de hidrógeno
b) la síntesis de amoníaco (el Proceso Haber)
La fabricación de hidrógeno implica varios procesos distintos. La figura 2 muestra su secuencia y la ubicación dentro de una planta de amoníaco (pasos1-5). También se muestra el convertidor utilizado para fabricar amoníaco a partir del hidrógeno (paso 6). Lo que ocurre en cada uno de estos pasos se describe debajo de la figura.
|
Figura 2 Una planta de amoníaco en Australia Occidental: 1 Unidades de desulfuración |
.jpg) |
(a) La fabricación de hidrógeno
El hidrógeno se produce a partir de diversas materias primas, principalmente del gas natural, el carbón o la nafta. Las formas de obtener hidrógeno a partir de estas materias primas se tratan por separado.
Hidrógeno a partir de gas natural (metano)
Esto implica dos etapas:
i) la fabricación de gas de síntesis (una mezcla de monóxido de carbono e hidrógeno (reformado con vapor))
ii) la eliminación del monóxido de carbono y la producción de una mezcla de hidrógeno y nitrógeno (la reacción de desplazamiento)
(i) La fabricación de gas de síntesis
Cualquiera que sea la forma en que se obtenga el metano, contendrá algunos compuestos orgánicos de azufre y sulfuro de hidrógeno, los cuales deben ser eliminados. De lo contrario, envenenarán el catalizador necesario para la fabricación del gas de síntesis. En la unidad de desulfuración, los compuestos orgánicos de azufre suelen convertirse primero en sulfuro de hidrógeno, antes de reaccionar con el óxido de zinc. La materia prima se mezcla con hidrógeno y se hace pasar por un catalizador de óxidos mixtos de cobalto y molibdeno sobre un soporte inerte (una alúmina especialmente tratada) a unos 700 K.
.jpg)
Luego los gases se hacen pasar por el óxido de zinc a unos 700 K y se elimina el sulfuro de hidrógeno:
.jpg)
El reformado de vapor primario convierte el metano y el vapor en gas de síntesis, una mezcla de monóxido de carbono e hidrógeno:
.jpg)
Altas temperaturas y bajas presiones favorecen la formación de los productos (Principio de Le Chatelier). En la práctica, los reactivos pasan sobre un catalizador de níquel, finamente dividido en la superficie de un soporte de óxido de calcio/óxido de aluminio contenido en tubos verticales de aleación de níquel. Los tubos, hasta 350 en paralelo, se calientan en un horno por encima de 1000 K y bajo una presión de aproximadamente 30 atm. Este es un ejemplo de reactor tubular.
El reformado de vapor secundario hace reaccionar el oxígeno del aire con parte del hidrógeno presente y la mezcla resultante se hace pasar por un catalizador de níquel. El vapor y el calor producidos por la combustión reforman la mayor parte del metano residual. Entre las reacciones clave están:
small.jpg)
El gas emergente de esta etapa exotérmica neta está a unos 1200 K y se enfría en intercambiadores de calor. El vapor que se forma a partir del agua utilizada en el enfriamiento de los gases se utiliza para el funcionamiento de las turbinas y, por tanto, de los compresores y para precalentar los reactantes.
Algunos diseños recientes utilizan el calor residual del reformador secundario directamente para proporcionar calor al reformador primario.
En esta etapa el gas contiene hidrógeno, nitrógeno, monóxido de carbono y dióxido de carbono y aproximadamente un 0,25% de metano. Como el aire contiene un 1% de argón, éste también se acumula en el gas de síntesis.
(ii) La reacción de cambio
Este proceso convierte el monóxido de carbono en dióxido de carbono, a la vez que genera más hidrógeno.
Tiene lugar en dos etapas. En la primera, la reacción de desplazamiento a alta temperatura, el gas se mezcla con vapor y se hace pasar por un catalizador de óxido de hierro/cromo (III) a unos 700 K en un reactor de lecho fijo. Esto reduce la concentración de monóxido de carbono del 11%:
.jpg)
En la segunda etapa, la reacción de desplazamiento a baja temperatura, la mezcla de gases se hace pasar por un catalizador de cobre-zinc a unos 500 K. La concentración de monóxido de carbono se reduce aún más hasta el 0,2%.
La reacción se realiza en dos etapas por varias razones. La reacción es exotérmica. Sin embargo, a alta temperatura, la concentración de salida de monóxido de carbono sigue siendo bastante alta, debido al control del equilibrio. El catalizador de cobre utilizado en la etapa de baja temperatura es muy sensible a las altas temperaturas, y no podría funcionar eficazmente en la etapa de alta temperatura. Por ello, la mayor parte de la reacción se lleva a cabo a alta temperatura para recuperar la mayor parte del calor. A continuación, el gas se extrae a baja temperatura, donde el equilibrio es mucho más favorable, en el catalizador de cobre, muy activo pero inestable.
La mezcla de gas contiene ahora alrededor de un 18% de dióxido de carbono que se elimina lavando el gas con una solución de una base, utilizando uno de los varios métodos disponibles. Uno de los métodos preferidos es una base orgánica (en el absorbedor de dióxido de carbono), una solución de una etanolamina, a menudo 2,2′-(metilimino)bis-etanol (N-metil dietanolamina).
El dióxido de carbono se libera al calentar la solución en el extractor de dióxido de carbono). Gran parte de él se licua y se vende, por ejemplo, para las bebidas carbonatadas, como refrigerante para las centrales nucleares y para promover el crecimiento de las plantas en los invernaderos.
Los últimos restos de óxidos de carbono se eliminan haciendo pasar los gases por un catalizador de níquel a 600 K:
.jpg)
Este proceso se conoce como metanación. Se obtiene un gas de composición típica: 74% de hidrógeno, 25% de nitrógeno, 1% de metano, junto con algo de argón.
Hidrógeno a partir de nafta
Si se utiliza nafta como materia prima, se necesita una etapa adicional de reformado. La nafta se calienta para formar un vapor, se mezcla con vapor y se hace pasar por unos tubos, calentados a 750 K y empaquetados con un catalizador, níquel soportado en una mezcla de óxidos de aluminio y magnesio. El producto principal es el metano junto con los óxidos de carbono, y se procesa por reformado con vapor, como si fuera gas natural, seguido de la reacción de desplazamiento.
Hidrógeno a partir de carbón
Si se utiliza carbón, primero se muele finamente y se calienta en una atmósfera de oxígeno y vapor. Una parte del carbón se quema muy rápidamente en el oxígeno (en menos de 0,1 s) provocando el aumento de la temperatura en el horno y el resto del carbón reacciona con el vapor:
.jpg)
El gas emitido contiene aproximadamente un 55% de monóxido de carbono, un 30% de hidrógeno, un 10% de dióxido de carbono y pequeñas cantidades de metano y otros hidrocarburos. Esta mezcla es tratada por la reacción de desplazamiento.
Los principales problemas de la utilización del carbón incluyen las grandes cantidades de dióxido y trióxido de azufre que se generan al quemar el carbón y las cantidades significativas de otras impurezas como el arsénico y el bromo, todas ellas muy perjudiciales para la atmósfera y todas ellas graves venenos para los catalizadores del proceso. También hay un enorme problema con la eliminación de las cenizas.
Hidrógeno a partir de biomasa
Se puede producir gas de síntesis a partir de la biomasa. El proceso se describe en la unidad sobre biorrefinerías.
(b) La fabricación de amoníaco (El Proceso Haber)
.jpg)
El corazón del proceso es la reacción entre el hidrógeno y el nitrógeno en un reactor de lecho fijo. Los gases, en proporciones estequiométricas, se calientan y pasan a presión sobre un catalizador (Figura 3).
.jpg)
Figura 3 Un diagrama que ilustra un reactor de síntesis convencional (un convertidor).
La proporción de amoníaco en la mezcla de equilibrio aumenta con el aumento de la presión y con el descenso de la temperatura (Principio de Le Chatelier). Los datos cuantitativos se recogen en la Tabla 1. Para obtener un rendimiento razonable y una velocidad favorable, se utilizan presiones altas, temperaturas moderadas y un catalizador.
| Presión/atm | Porcentaje de amoníaco presente en el equilibrio a un rango de temperaturas | |||||
|---|---|---|---|---|---|---|
| 373 K | 473 K | 573 K | 673 K | 773 K | ||
| 10 | – | 50.7 | 14,7 | 3,9 | 1.2 | 0,2 | 25 | 91,7 | 63,6 | 27.4 | 8,7 | 2,9 | – | 50 | 94.5 | 74,0 | 39,5 | 15,3 | 5.6 | 1,1 | 100 | 96.7 | 81,7 | 52,5 | 25,2 | 10.6 | 2,2 | 200 | 98,4 | 89.0 | 66,7 | 38,8 | 18.3 | – | 400 | 99.4 | 94,6 | 79,7 | 55.4 | 31,9 | – |
| 1000 | – | 98.3 | 92,6 | 79,8 | 57,5 | 12.9 |
Tabla 1 Porcentaje, en volumen, de amoníaco en la mezcla de equilibrio para la reacción
entre nitrógeno e hidrógeno a un rango de temperaturas y presiones.
Se utiliza un amplio rango de condiciones, dependiendo de la construcción del reactor. Las temperaturas utilizadas varían entre 600 y 700 K, y las presiones entre 100 y 200 atmósferas. Se está trabajando mucho para mejorar la eficacia del catalizador de modo que puedan utilizarse presiones de hasta 50 atmósferas.
Como la reacción es exotérmica, se añaden reactivos fríos (nitrógeno e hidrógeno) para reducir la temperatura de los reactores (Figura 3).
El amoníaco suele almacenarse in situ (paso 7) y se bombea a otra parte de la planta donde se convierte en un fertilizante (urea o una sal de amonio). Sin embargo, a veces se transporta por mar (Figura 4) o por carretera, para ser utilizado en otra planta.
.jpg) |
Figura 4 En una planta de Australia Occidental, el amoníaco se traslada por tubería a un puerto cercano (Figura 2, paso 8) y se transporta por barco. Este lleva unas 40 000 toneladas de amoníaco licuado. Con la amable autorización de Yara International ASA. |
El catalizador original que utilizaba Haber era Fe3O4, que se reducía con el reactivo, el hidrógeno, a hierro. Se trabajó mucho para mejorar el catalizador y se descubrió que una pequeña cantidad de hidróxido de potasio era eficaz como promotor.
Recientemente la investigación se ha centrado en encontrar catalizadores aún más eficaces que permitan que el proceso tenga lugar a presiones y temperaturas más bajas. El rutenio sobre una superficie de grafito es uno de los más prometedores.
.jpg)
Figura 5 La producción de amoníaco.
Postdata
El Proceso Haber es de tal importancia para nuestras vidas que ha figurado en tres Premios Nobel de Química, todos ellos a científicos alemanes, en un período de casi 90 años, un récord notable.
El primero fue otorgado en 1918, a Fritz Haber, el químico que desarrolló el proceso en el laboratorio. El segundo fue para Carl Bosch, cuyas brillantes habilidades de ingeniería hicieron viable el proceso a gran escala, pero que esperó hasta 1931 para recibir su premio.
En 2007, Gerhard Ertl fue galardonado con el Premio por su trabajo sobre la catálisis de reacciones gaseosas en sólidos. Entre la amplia gama de reacciones que estudió, obtuvo pruebas de la adsorción de moléculas de nitrógeno y de hidrógeno en la superficie del hierro y de que estas moléculas adsorbidas se disocian en átomos. A continuación, estos átomos se unen por etapas para formar la molécula de amoníaco. Hay que tener en cuenta que las condiciones utilizadas en estos estudios (a menos de 10-10 atm) son muy diferentes de las condiciones utilizadas en la industria, ca 150 atm.
Resumen
El proceso completo de producción de amoníaco a partir de metano se resume en la figura 5. Si la materia prima es carbón o nafta, se necesitan procesos adicionales. La nafta se convierte en metano y óxidos de carbono antes de pasar al reformador primario y, de ahí, a la reacción de cambio. El carbón también se convierte en hidrógeno y óxidos de carbono y esta mezcla se somete a la reacción de cambio.