Crecimiento y proliferación de tumores
En circunstancias normales, mTOR es un importante regulador del crecimiento y la división celular. Sin embargo, en las células tumorales, un mTOR anormalmente activado envía señales que animan a las células tumorales a crecer, hacer metástasis e invadir nuevos tejidos sanos . Entre ellas, la vía PI3K/fosfato y homología de hongos eliminada en el cromosoma 10 (PTEN)/AKT/TSC es el principal activador de mTORC1, y las mutaciones genéticas en esta vía pueden dar lugar a tumores malignos . Además, la expresión de PTEN se elimina a menudo por modificación epigenética, genética y postranscripcional para regular al alza la vía PI3K/Akt/mTOR en la mayoría de los tumores malignos .
Hou et al. encontraron que las mutaciones en el gen PTEN conducían a una activación anormal de la vía PI3K/PTEN en el carcinoma de células hepáticas (HCC). Además, la deleción del gen PTEN induce la expresión de B7-H1, que conduce a la inmunosupresión y aumenta la progresión e invasión del tumor . En el cáncer de hígado, la vía PI3K/PTEN/Akt/mTOR activada está implicada en la invasión tumoral y la metástasis mediante la regulación al alza de la metalopéptida de matriz 9 (MMP-9) . Asimismo, se ha descubierto que la vía de señalización PI3K/Akt/mTOR controla la proliferación y la supervivencia de las células madre del cáncer de colon (CCSC). En el cáncer de colon esporádico, las CCSC pueden causar recurrencia y metástasis. Xie et al. descubrieron que la mutación del gen de la quinasa hepática B1 (LKB1) o la señal de crecimiento extracelular podían activar mTORC1. MTORC1 inhibe la actividad de la proteína ring finger 168 (RNF168) y promueve su degradación fosforilando la serina 60 de RNF168. Esto reducirá significativamente la modificación de la ubiquitinación de la histona H2A y del miembro X de la familia de histonas H2A (H2AX) después de un daño en el ADN, lo que inhibirá la respuesta al daño en el ADN y reducirá la estabilidad del genoma, lo que conducirá a la promoción de la transformación de las células malignas y del cáncer. Además, las investigaciones existentes muestran que Rheb es una GTPasa que se une y activa a mTORC1 cuando se carga GTP. Deng et al. informaron de que la ubiquitinación de Rheb estaba regulada por las señales del factor de crecimiento. La ubiquitinación de Rheb inhibe la actividad de Rheb al promover la unión de Rheb a TSC2, lo que conduce a la inhibición de la expresión de mTORC1. Además de la vía mTORC1, la vía mTORC2 también está implicada en la regulación de la aparición y el desarrollo de células tumorales. Wang et al. demostraron que la OTU deubiquitinasa 7B (OTUD7B) redujo el nivel de ubiquitinación de GβL para evitar que GβL interactuara con SIN1, lo que llevó a la activación de la vía de señalización mTORC2/AKT y a la regulación a la baja de la expresión de mTORC1. Esto activa parcialmente la señalización oncogénica de AKT y promueve la tumorigénesis. Sin embargo, la ubiquitina ligasa TNF Receptor Associated Factor 2 (TRAF2) tiene el efecto contrario al aumentar el nivel de ubiquitinación de GβL. De forma similar, Kovalski et al. demostraron que las mutaciones de Ras pueden unirse a mTOR de mTORC2 y a la proteína 1 asociada a la proteína activada por mitógenos (MAPKAP1) para promover la actividad de la quinasa mTORC2, iniciando así los programas de transcripción del ciclo celular proliferativo aguas abajo.
En resumen, mTOR está siempre estimulada en los tumores para mantener el crecimiento, la supervivencia y la proliferación de las células tumorales, y desempeña un papel clave en la biología de las células tumorales (Fig. 1).
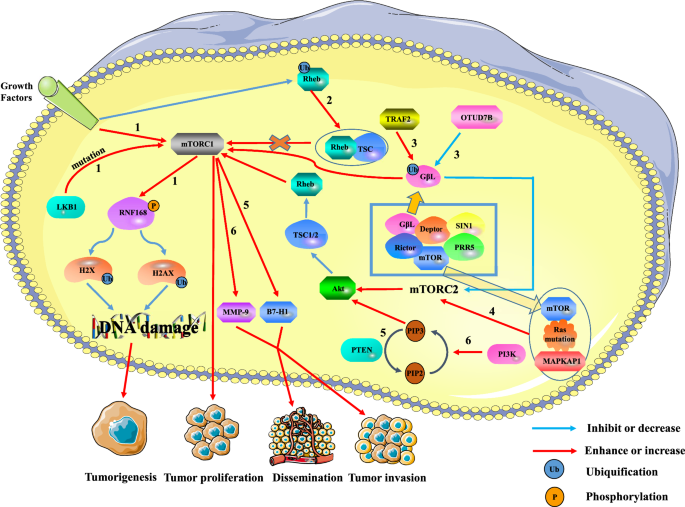
La relación entre mTOR y los tumores. La sobreactivación de mTORC1 puede promover la formación de tumores, la proliferación y la metástasis, mientras que mTORC2 puede regular la expresión de mTORC1 a través de la vía mTORC2/AKT/TSC/Rehb. Vía 1: Las señales extracelulares de crecimiento y las mutaciones intracelulares de LKB1 activan a mTORC1, que reduce la ubiquitinación de la histona H2A y H2A tras el daño del ADN mediante la fosforilación de RNF168. Esto puede provocar daños en la reparación del ADN y promover la formación de tumores. Vía 2: La ubiquitinación de Rheb reduce la actividad de Rheb al promover la unión de Rheb a TSC2. La regulación a la baja de Rheb reduce la activación de mTORC1, lo que conduce a la inhibición del crecimiento tumoral. Vía 3: TRAF2 y Otud7B regulan respectivamente la actividad de mTORC1/2 mediante la regulación al alza o a la baja del nivel de ubiquitinación de G beta L de mTORC2. TRAF2 aumentó la actividad de mTORC1 e inhibió la de mTORC2. Aunque la regulación a la baja de la expresión de mTORC2 inactiva la vía AKT/TSC/Rehb/mTORC1, la actividad general de mTORC1 se ve potenciada. Sin embargo, Otud7B tiene el efecto contrario sobre TRAF2. Vía 4: El Ras mutado se une a mTOR y a MAPKAP1 de mTORC2 para promover la expresión de mTORC2. La regulación al alza de mTORC2 promueve la proliferación tumoral a través de la vía AKT/TSC/Rehb/mTORC1. Vía 5: La supresión del gen PTEN induce la expresión de B7-H1 para aumentar la progresión e invasión tumoral. Vía 6: La vía PI3K/PTEN/AKT/mTOR está implicada en la invasión y metástasis del cáncer de hígado mediante la regulación al alza de la MMP-9
Metabolismo tumoral
mTOR se activa cuando los nutrientes son suficientes, lo que promueve el anabolismo y el almacenamiento y utilización de energía. Cuando los nutrientes son relativamente escasos, el cuerpo debe inhibir la activación de mTOR para mantener el material celular y la energía estables. Las células tumorales requieren grandes cantidades de proteínas, lípidos y nucleótidos para responder a sus necesidades de crecimiento y división . Por lo tanto, la actividad anormal de la vía mTOR se produce a menudo en los tumores, porque mTOR desempeña un papel central en la regulación del metabolismo.
En las células de cáncer de mama, la vía PI3K/AKT/mTORC1/proteína de unión a elementos reguladores del esterol (SREBP) es el principal mecanismo para inducir la síntesis de nuevos lípidos y promover la proliferación del tumor . La piruvato quinasa (PK) está implicada en el metabolismo de los azúcares, mientras que la sintasa de ácidos grasos (FASN) participa en la síntesis de ácidos grasos (AG). Tao et al. descubrieron que la regulación a la baja de la expresión de la piruvato quinasa M2 (PKM2) desactiva la vía de señalización AKT/mTOR, reduciendo así la expresión de SREBP-1c. El nivel de expresión reducido de SREBP-1c inhibe la generación de AF mediante la inhibición de la transcripción del gen FASN, lo que da lugar a la inhibición del crecimiento de las células tumorales. Además, Di Malta et al. informaron de que el gen potenciador del factor de transcripción (TFE) regulado al alza puede activar la vía Rag GTPasa/mTORC1. En las células normales, esta vía se activa para que las células puedan absorber mejor los nutrientes para mantener las funciones fisiológicas. En las células tumorales, esta vía suele activarse en exceso para satisfacer las necesidades nutricionales de las células tumorales en rápido crecimiento. Sin embargo, Guri et al. exploraron que mTORC2 promovía la producción de esfingomielina y cardiolipina en el CHC. Por un lado, la esfingomielina y los fosfolípidos cardíacos son componentes estructurales de las biopelículas celulares. Por otro lado, el metabolismo y el transporte de los fosfolípidos cardíacos contribuyen al buen funcionamiento de las mitocondrias, por lo que deben ser suministrados en grandes cantidades en las células tumorales de rápida proliferación . Estos resultados sugieren que la vía de señalización mTORC2 promueve la proliferación del CHC y la producción de lípidos relacionados con la energía.
Como se ha mencionado anteriormente, los metabolismos de las células tumorales pueden ser regulados por la vía mTOR para satisfacer sus necesidades proliferativas y nutricionales. A la inversa, el metabolismo de las células tumorales también puede promover el crecimiento del tumor a través de la vía mTOR. Ericksen et al. demostraron que la reducción de la descomposición de los aminoácidos de cadena ramificada (BCAA) podría promover la aparición y el desarrollo de tumores al aumentar la actividad de mTORC1. También concluyeron que la actividad de la enzima clave en el proceso de catabolismo de los BCAA estaba altamente correlacionada con la invasión tumoral. Por lo tanto, la acumulación de BCAAs causada por la inhibición del catabolismo de los BCAAs en los tejidos tumorales del hígado puede ser el mecanismo principal de la activación crónica de mTORC1 del tumor. De forma similar, Shi et al. mostraron que la expresión del receptor de adenosina A2a (A2aR) en los tejidos del cáncer gástrico (GC) estaba aumentada, y la expresión de A2aR estaba positivamente correlacionada con el estadio del GC. Los resultados sugieren que la adenosina activa la vía de señalización PI3K/AKT/mTOR al unirse al A2aR, lo que en última instancia promueve el progreso del CG. Madak-Erdogan et al. descubrieron que los ácidos grasos libres (AGL) activaban las vías del receptor de estrógeno α (ERα) y de mTOR, que se correlacionaban con una mayor proliferación e invasividad de las células de cáncer de mama ER (+).
Estos estudios indican que la vía de señalización mTOR está estrechamente relacionada con el metabolismo tumoral, y proporcionan un apoyo teórico para la aplicación combinada de inhibidores de mTOR y algunos fármacos que interfieren en el metabolismo tumoral (Fig. 2).
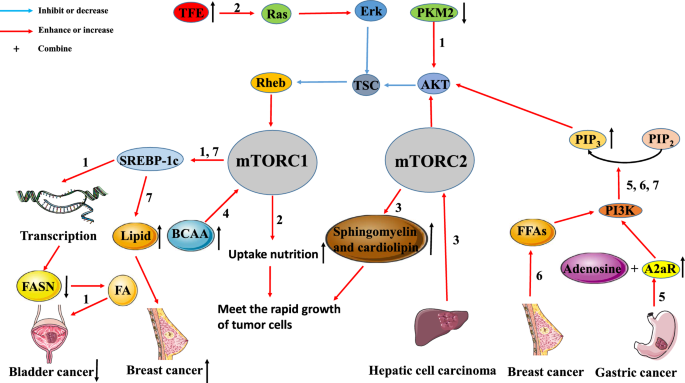
Interacción entre el metabolismo tumoral y la vía de señalización mTOR. La vía mTOR está estrechamente relacionada con el metabolismo tumoral. Vía 1: En el cáncer de vejiga, la regulación a la baja de la expresión de PKM2 reduce la expresión de SREBP-1 a través de la inactivación de la vía AKT/TSC/Rehb/mTORC1. La regulación a la baja de SREBP-1c inhibe la generación de AF mediante la inhibición de la transcripción de FASN, lo que conduce a la inhibición del crecimiento del tumor). Vía 2: La regulación al alza del FAT en los tumores activa la vía Ras/Erk/TSC/Rehb/mTORC1. La activación de esta vía promoverá la captación de nutrientes por parte de las células tumorales para satisfacer las necesidades del rápido crecimiento de los tumores. Vía 3: El CHC puede aumentar la producción de esfingomielina y cardiolipina mediante la activación de mTORC2. Se utilizan grandes cantidades de esfingomielina y cardiolipina para ensamblar las membranas celulares, que también satisfacen las necesidades de la rápida proliferación tumoral. Vía 4: La acumulación de BCAA puede promover la aparición y el desarrollo de tumores mediante la activación de mTORC1. Vía 5: El A2aR, altamente expresado en el cáncer gástrico, se une a la adenosina para activar la vía PI3K/AKT/mTORC1. Vía 6: En el cáncer de mama, los AGF promueven la proliferación tumoral y la metástasis mediante la activación de la vía PI3K/AKT/mTORC1. Vía 7: La vía PI3K/AKT/mTORC1/SREBP promueve la proliferación del cáncer de mama al inducir la síntesis de nuevos lípidos
Células inmunitarias
Los tumores pueden desarrollar tolerancia inmunitaria al suprimir la capacidad del sistema inmunitario para reconocer y eliminar las células tumorales. La inmunoterapia de los tumores es un tema de investigación candente en los últimos años , y diversas pruebas demuestran que la vía mTOR, que suele estar anormalmente activada en los tumores, puede regular la diferenciación y la función de las células inmunitarias.
Células T
Las células progenitoras T de la médula ósea entran en el timo, donde se diferencian en dos tipos de células: las células αβ T y las células γδ T. Mediante el experimento de knockout del gen, Yang et al. demostraron que la supresión de RAPTOR en mTORC1 rompería el proceso de remodelación del metabolismo oxidativo y del metabolismo de la glucosa durante la diferenciación de las células T. Esto desencadena la producción de especies reactivas de oxígeno (ROS), que interrumpe la diferenciación de las células αβ T y aumenta la diferenciación de las células γδ T. Además, Essig et al. demostraron que la roquina podía regular a la baja la expresión de la vía PI3K/mTOR. La regulación a la baja de la vía PI3K/mTOR no sólo inhibe la diferenciación y activación de las células T tradicionales, sino que también limita la especialización de las células Treg. Pollizzi et al. descubrieron en modelos de ratón que la activación de mTORC1 fomentaba la producción de un grupo de células T efectoras (CD) 8+ con una elevada glucólisis. Estas células T conservan el fenotipo efector pero no se convierten en un fenotipo de memoria. Por el contrario, las células T con actividad reducida de mTORC1 tienen las características de las células de memoria pero no pueden diferenciarse en células efectoras, y no pueden producir una respuesta de memoria inmunitaria debido a la función metabólica defectuosa. Otros estudios demostraron que mTORC1 podía afectar a la función efectora de las células T CD8+, mientras que la actividad de mTORC2 regulaba la capacidad de memoria de las células T CD8+.
En general, la vía de señalización de mTOR puede afectar a la diferenciación y la función de las células T. Estos estudios amplían nuestra comprensión actual de la biología de las células T.
Células asesinas naturales y células dendríticas
La vía de señalización mTOR no sólo regula las células T, sino que está estrechamente relacionada con la diferenciación y las funciones de las células dendríticas (DC) y las células asesinas naturales (NK). Las DC tienen una gran capacidad de presentación de antígenos, y las células NK son importantes células inmunitarias en el organismo. Wang et al. demostraron que mTORC1 y mTORC2 regulan los efectos de las células NK de una manera única. Descubrieron que mTORC2 regula negativamente la función de las células NK, principalmente mediante la inhibición del eje transductor de señales y activador de la transcripción 5 (STAT5)/miembro 5 de la familia de transportadores absolutos (SLC7A5). Mientras que mTORC1 regula positivamente la actividad de mTORC2 manteniendo la vía de señalización de la interleucina (IL)-15 mediada por CD122. Además de las células NK, en los últimos años también se cree que el DC está relacionado con la vía de señalización de mTOR. Chen et al. concluyeron que la apoptosis de las DC derivadas de células mononucleares de la médula ósea (BMM) se reducía tras el tratamiento con inhibidores de mTOR. También descubrieron que las DC derivadas de células BMM tenían una mejor capacidad de presentación de antígenos y que los linfocitos T CD8+ citotóxicos específicos de e7 activados por estas DC tenían una mayor actividad antitumoral. Por lo tanto, los inhibidores de mTOR pueden aumentar la eficacia de la inmunoterapia tumoral alargando la vida de las DC, mejorando la presentación de antígenos y la capacidad de procesamiento de los mismos. Estos estudios aportan ideas para dirigir las células NK y DC a la terapia antitumoral.
Macrófagos
Los macrófagos de tipo M1 pueden eliminar las células tumorales de múltiples maneras, mientras que los macrófagos de tipo M2 promueven la aparición, invasión y metástasis de los tumores. Zhihua et al. informaron de que la expresión del microARN (miARN)-30c se reducía significativamente en el CG. Otros estudios demostraron que el factor inducible por hipoxia-1α (HIF-1α) inhibía la expresión de miRNA-30c. La regulación a la baja de miRNA-30c reducirá la actividad de mTOR y la glucólisis en los macrófagos relacionados con el tumor. Esto acabará promoviendo el crecimiento y la metástasis del GC mediante la inhibición de la diferenciación y la función de los macrófagos de tipo M1.
En general, la vía mTOR, que suele activarse en los tumores, promueve el crecimiento tumoral mediante la regulación de la diferenciación y la función de las células inmunitarias. Esto desempeñará un papel positivo en la exploración de nuevas inmunoterapias y en la mejora del tratamiento de los tumores.
Resistencia a los fármacos de los tumores
Apuntar a las vías moleculares de las células tumorales es la forma en que tratamos varios tipos de cáncer, pero los tumores inevitablemente desarrollan resistencia a los fármacos . Una vez que el tumor se vuelve resistente, los efectos secundarios del tratamiento aumentan mientras que la eficacia del fármaco disminuye significativamente.
Los tumores del sistema digestivo
Los estudios han demostrado que la proteína desacoplante mitocondrial 2 (UCP2) conduce a la resistencia del tumor a múltiples fármacos contra el cáncer mediante la reducción de ROS generados por el metabolismo mitocondrial. Dando et al. demostraron que la combinación de genipina y everolimus podía inhibir sinérgicamente el crecimiento de las células del adenocarcinoma de páncreas (PAAD) e inducir la autofagia de las células tumorales. Esto se debe a que la inhibición de UCP2 en las células del PAAD activa la vía Akt/mTOR por un mecanismo dependiente de ROS, lo que reduce el efecto antiproliferación del inhibidor de UCP2 genipin. La vía hedgehog mediada por la proteína zinc finger GLI1 juega un papel importante en el CG. Sin embargo, Yao et al. demostraron que la vía AKT/mTOR puede activar GLI1. Además, las expresiones de GLI1 y p-AKT se correlacionaron con la metástasis de las células tumorales y la resistencia a los fármacos, y el nivel de expresión se correlacionó negativamente con el pronóstico de los pacientes con CG.
Tumores respiratorios
El inhibidor de wee1 AZD1775, que se dirige a la reparación del ADN y a los puntos de control del ciclo celular, ha demostrado ser eficaz en algunos pacientes con cáncer de pulmón, pero la resistencia al fármaco también es común . A este respecto, Sen et al. descubrieron que la expresión del receptor tirosina quinasa AXL (ARK) en el cáncer de pulmón de células pequeñas (CPCP) resistente al AZD1775 estaba regulada al alza. ARK puede activar directamente o a través de mTOR la vía de las proteínas quinasas reguladas extracelularmente (ERK) para reclutar y activar la quinasa de punto de control 1 (CHK1). Estos resultados sugieren que ARK puede mejorar la reparación del daño en el ADN mediante la activación de CHK1, lo que en última instancia invalida el inhibidor de Wee1. Del mismo modo, Ye et al. demostraron que en el cáncer de pulmón de células no pequeñas (NSCLC), el miembro-1 de la familia transmembrana-4 L-six (TM4SF1) regula la sensibilidad del tumor a los fármacos de quimioterapia mediante la regulación de la expresión del receptor de dominio discoide 1 (DDR1)/la vía Akt/ERK/mTOR.
Cáncer de riñón y cáncer de piel
Los inhibidores de la tirosina quinasa (TKI) pueden utilizarse para tratar el carcinoma de células renales (CCR), pero algunos pacientes con CCR desarrollarán resistencia a los fármacos . Ishibashi et al. informaron de que el tratamiento combinado de un inhibidor del receptor de la interleucina 6 (IL-6R) y una dosis baja de inhibidores de la TKI era más eficaz para inhibir el crecimiento y la angiogénesis del CCR in vivo en comparación con el uso del inhibidor de la TKI solo. Esto se debe a que las dosis bajas de inhibidores TKI inducen altos niveles de IL-6, que activa la vía AKT/mTOR. Estos resultados sugieren que el mecanismo de fracaso de los inhibidores TKI en algunos pacientes con CCR está relacionado con la elevada activación de la IL-6 de la vía de señalización mTOR.
Las mutaciones del protooncogén B-Raf (BRAF) se producen en el cáncer de piel no melanoma (CPNM), pero los inhibidores de BRAF no se han utilizado en dichos tumores. La razón principal es que los NMSC con mutaciones en BRAF presentan una resistencia primaria o secundaria a los inhibidores de BRAF. Sen et al. encontraron una fuerte correlación entre la vía de señalización PI3K/mTOR y la resistencia a los inhibidores de BRAF. Esto sugiere que la activación de la vía mTOR puede conducir a la resistencia de los NMSC mutados en BRAF a los inhibidores de BRAF. Además, Obenauf et al. descubrieron que los inhibidores de BRAF, de la tirosina quinasa del receptor anaplásico (ALK) y del receptor del factor de crecimiento epidérmico (EGFR) inducían algunas señales de secreción en las células cancerosas, lo que conducía a la proliferación y metástasis de las células tumorales resistentes a los fármacos. Otros estudios han descubierto que en las células de melanoma tratadas con un inhibidor de BRAF, la regulación a la baja del factor de transcripción FOS related antigen-1 (FRA1) activa múltiples vías de señalización, entre las que la vía PI3K/AKT/mTOR desempeña un papel importante. Cuando se inhiben simultáneamente las vías de señalización BRAF y PI3K/AKT/mTOR, se puede inhibir el crecimiento de las células de melanoma humano con mutación BRAF resistentes a los fármacos.
Los estudios anteriores sugieren que las células tumorales pueden evadir la muerte celular inducida por los fármacos antitumorales mediante la activación de la vía de señalización mTOR intracelular, por lo que la activación de la vía de señalización mTOR puede ser uno de los mecanismos de resistencia a los fármacos en los tumores. Las combinaciones de fármacos dirigidas a la vía de señalización mTOR pueden utilizarse para tratar los tumores que han desarrollado resistencia.
Autofagia y apoptosis del cáncer
Por un lado, la autofagia puede mantener el genoma estable eliminando los orgánulos dañados y las proteínas mal plegadas, por lo que puede inhibir el crecimiento de las células cancerosas . Por otro lado, la autofagia proporciona al tumor más nutrientes, lo que refuerza la capacidad del tumor para hacer frente a entornos extremos . Además, la proliferación ilimitada de los tumores se debe en parte a la inhibición de la apoptosis de las células tumorales.
Sun et al. concluyeron que mTOR inhibe la expresión de la glucógeno sintasa quinasa-3 (GSK-3) en las células de cáncer de próstata. La regulación a la baja de GSK-3 inhibirá la vía de señalización de la caspasa-3, lo que conducirá a la reducción de la producción de ROS. La disminución de ROS inhibe la apoptosis de las células tumorales para proteger las células del cáncer de próstata. Sin embargo, Zou et al. informaron de que mTORC2 impedía que el inhibidor canceroso de la proteína fosfatasa 2A (CIP2A) se uniera a la proteína fosfatasa 2A (PP2A) para restaurar la actividad de la PP2A. PP2A reduce la transcripción de miR-9-3p y regula al alza la expresión del factor de transcripción E2F 1 (E2F1) promoviendo la degradación de c-Myc, por lo que inhibe la apoptosis de las células tumorales. Además, Yang et al. informaron de que la expresión de p-AKT, p-mTOR, P62 y el linfoma de células B-2 (BCL-2) disminuyó significativamente en las células del carcinoma oral de células escamosas (OSCC) con el knockdown del ARN no codificante largo (lncRNA) CASC9, mientras que la expresión del X asociado a BCL2 (BAX) aumentó. Estos resultados sugieren que el lncRNA CASC9 inhibe la apoptosis mediada por la autofagia a través de la vía AKT/mTOR, lo que promueve la proliferación de las células de OSCC.
En resumen, los estudios anteriores indican que la vía de señalización mTOR puede promover la aparición y progresión de los tumores mediante la regulación de la autofagia y la apoptosis de las células tumorales. Además, la investigación anterior también proporciona apoyo teórico para la investigación clínica de los fármacos dirigidos contra el cáncer, lo cual es de gran importancia.