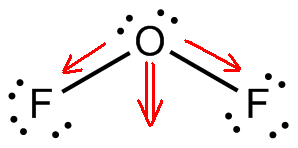
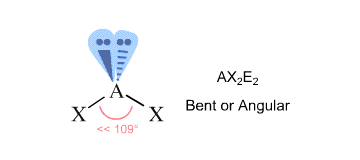El difluoruro de oxígeno, #»OF»_2#, es una molécula polar porque tiene una geometría molecular curvada.
Esta geometría molecular asegura que los momentos dipolares asociados a los enlaces oxígeno – flúor no se cancelen entre sí para producir una molécula no polar.
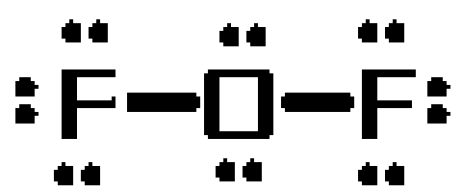
Para ver por qué esto es así, dibuje la estructura de Lewis de la molécula. La molécula tendrá un total de #20# electrones de valencia
- #6# del átomo de oxígeno
- #7# de cada uno de los dos átomos de flúor
El átomo de oxígeno tomará el papel de átomo central, formando enlaces simples con los dos átomos de flúor. Estos enlaces supondrán el #4# de los #20# electrones de valencia de la molécula.
Los #16# electrones resultantes se colocarán como pares solitarios
- tres pares solitarios en cada átomo de flúor
- dos pares solitarios en el átomo de oxígeno
Ahora, es muy importante darse cuenta de que las estructuras de Lewis no pretenden transmitir la geometría molecular.
Para encontrar la geometría de la molécula, se cuentan las regiones de densidad de electrones que rodean al átomo central – éstas le darán el número estérico del átomo.
Las regiones de densidad electrónica son los enlaces con otros átomos (aquí los enlaces simples, dobles o triples cuentan como una región) y los pares solitarios de electrones.
En tu caso, el átomo de oxígeno central está unido a otros dos átomos y está rodeado por dos pares solitarios #-># tiene un número estérico igual a #4#.
Según la Teoría VSEPR, esto corresponde a una geometría molecular #»AX»_2 «E»_2#, que es característica de una molécula doblada.
Ahora, la diferencia de electronegatividad entre el flúor y el oxígeno asegura que los dos enlaces #»O»-«F «# sean polares. La geometría molecular doblada hará que los dos momentos dipolares se sumen.
El resultado será la formación de un momento dipolar permanente y por tanto una molécula polar