La tabla periódica es una disposición tabular de los elementos químicos, ordenados por su número atómico, configuraciones electrónicas y propiedades químicas recurrentes. Este orden muestra tendencias periódicas , tales como elementos con comportamiento similar en la misma columna. En general, dentro de una fila (período) los elementos son metales en la izquierda, y no-metales en la derecha.
La tabla periódica es uno de los símbolos más emblemáticos de la ciencia, en ella se resumen muchos de los conocimientos de la química. En cualquiera de sus versiones está presente en aulas y laboratorios del mundo. Ninguna otra disciplina cuenta con un documento parecido.
El sistema periódico desarrollado en la segunda mitad del siglo XIX, proporcionó una ordenación sistemática de los elementos en grupos naturales. El alcance de esta ordenación permitió predecir con bastante certeza las propiedades de algunos elementos desconocidos y los probables compuestos que formaban. Desarrollos posteriores proporcionaron la base teórica de la Tabla Periódica actual. El gran número de elementos conocidos y sustancias sintetizadas generó la necesidad urgente de clasificarlos.
Un Poco de Historia Sobre la Tabla Periódica
A principios de 1812 el químico alemán John W. Döbereiner intentó una primera aproximación al ordenar los elementos descubiertos en grupos de tres. Esta clasificación implicó agruparlos en forma creciente de acuerdo con su masa atómica.
En 1860 el francés Alexandre Béguyer (un geólogo francés) verificó cierta periodicidad en los elementos al comparar sus tamaños y propiedades físicas. En sus estudios verificó una secuencia lógica entre las magnitudes y propiedades observadas en los átomos y sus respectivos tamaños y abundancias.
En 1864, Julius Lothar Meyer publicó la primera versión de la tabla periódica y más tarde el químico ruso Dmitri Ivanovich Mendeléiev enunció y publicó la Ley Periódica y La Tabla Periódica de los Elementos químicos.

Dmitri Ivanovich Mendeléiev
La capacidad predictiva de Mendeléiev fue brillante; no sólo enunció la ley de periodicidad química, también ordenó los elementos encontrados y guardó espacio para aquellos que aún no habían sido descubiertos, incluso predijo sus propiedades físicas y químicas.
La Tabla Periódica en la Actualidad
El comportamiento de los átomos está determinado por su configuración electrónica, siendo la distribución de los electrones en el nivel más externo la que determina su reactividad y naturaleza química. Por esta razón, aquellos elementos que poseen una distribución electrónica similar presentarán propiedades químicas similares.
Las propiedades de los átomos se repiten periódicamente si los elementos químicos se ordenan según su número atómico creciente (Z).
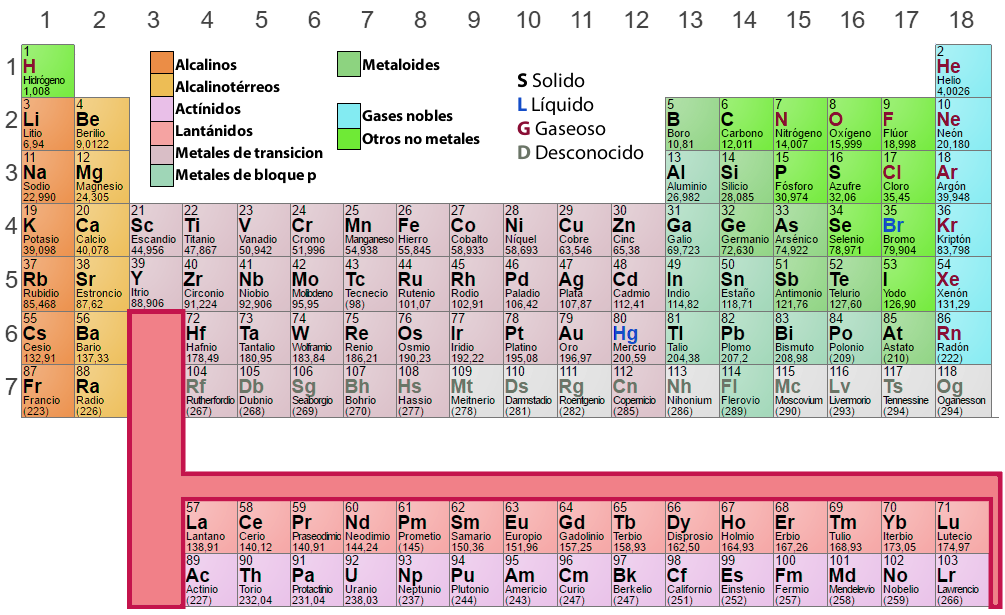
Análisis de la Tabla Periódica
En la tabla periódica, los elementos que tienen un patrón similar de configuración electrónica en la capa externa se disponen en las mismas columnas (Grupos o Familias). Aquellos elementos que presentan idénticos niveles energéticos se disponen en las mismas filas (Periodos).
Grupos o Familias
Es un ordenamiento vertical de los elementos en la tabla periódica, de acuerdo a propiedades químicas semejantes. La numeración tradicional de las dieciocho columnas es I A, II A, III A, IV A, etc, como vemos en la tabla periódica de más arriba. Actualmente, la IUPAC (Internacional Union of Pure and Applied Chemistry – Unión Internacional de Química Pura y Aplicada) recomienda la numeración sucesiva, es decir: 1, 2, 3, 4, 5, etc. Es importante considerar lo siguiente:
- El hidrógeno (H), a pesar de aparecer en el grupo IA (1), no es un metal alcalino. Al contrario, el hidrógeno
es tan diferente de los demás elementos químicos que algunas clasifiaciones prefiren colocarlo fuera de la
tabla. - Los grupos A son los más importantes de la tabla, sus elementos son denominados representativos.
- Los elementos de los grupos III B, IV B, V B, VI B, VII B, VIII B, I B y II B constituyen los llamados elementos
de transición. Note que el grupo VIII B es un grupo triple. - Otra separación importante que podemos hacer en la tabla periódica es aquella en la que dividimos los
elementos en metales, no metales y gases nobles.
Los elementos de un mismo grupo poseen propiedades químicas similares y se caracterizan por tener igual número de electrones en el último nivel de energía. Cada elemento de un grupo se ubica en períodos distintos y para designarlos se anota con numeración romana (I, II, III, IV, etc.) la cantidad de electrones en ese último nivel, seguido de una letra (A ó B) que identifica su naturaleza y los tipos de orbitales que presenta.
Periodos
Las siete líneas o filas horizontales que aparecen en la tabla periódica son denominados períodos, es importante notar que:
- En el sexto período la tercera cuadrícula encierra 15 elementos (del lantano a lutecio) que por comodidad, están indicados en una línea debajo de la tabla; comenzando con el lantano, esos elementos forman la llamada serie de los lantánidos.
- Analógicamente, en el séptimo período, la tercera cuadrícula también encierra 15 elementos químicos (del actinio hasta el laurencio), que están indicados en la segunda línea debajo de la tabla. Comenzando con el actinio, ellos forman la serie de los actínidos.
- Se debe señalar que todos los elementos situados después del uranio (U–92) no existen en la naturaleza, debiendo ser sintetizados artificialmente. Ellos son denominados elementos transuránicos. Aparte de estos elementos, son también artifiicales el tecnecio (Tc–43), promecio (Pm–61) y astato (As–85).
Los elementos de un mismo período presentan igual número de niveles energéticos con electrones. Los períodos se numeran considerando el valor del nivel energético más externo. Cada período comienza con un metal alcalino y concluye con un gas noble a excepción del primer nivel, donde se ubica el Hidrógeno.
Elementos en el Sistema Periodico
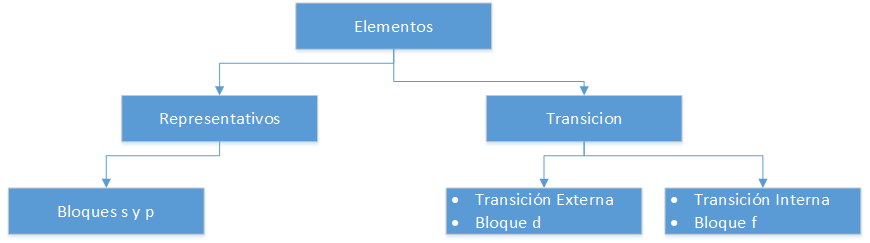
Elementos Representativos
Corresponden a los grupos A de la tabla periódica. No cumplen con la regla del octeto, es decir, su último nivel de energía no alcanza a tener 8 electrones. Así por ejemplo, los átomos de los elementos representativos pertenecientes al grupo III A, como el Aluminio (Al), tienen 3 electrones de valencia en su última capa, es decir, presentan incompletos los orbitales p (p1 al p6).
Los elementos de los grupos IA al VA, tienen la tendencia a ceder electrones para llegar a la configuración de gas noble (ns2 np6) más cercano. En cambio, los elementos de los grupos VI A y VII A, captan electrones para llegar a la configuración de gas noble más cercano.
| Grupo | Nombre | Configuración Electrónica |
|---|---|---|
| IA | Alcalinos | ns1 |
| IIA | Ale. térreos | ns2 |
| IIIA | Térreos | ns2np1 |
| IVA | Carbonados | ns2np2 |
| VA | Nitrogenados | ns2np3 |
| VIA | Calcógenos | ns2np4 |
| VIIA | Halógenos | ns2np5 |
| 0 | Gases nobles | ns2np6 |
Elementos de transición Externa
Se sitúan en los grupos B del sistema periódico. Los elementos pertenecientes a esta clasificación presentan orbitales d (d1 al d10) en su último nivel de energía.
Elementos de transición Interna
Se ubican en la zona inferior de la tabla periódica, también se les denomina tierras raras. Su principal característica es que presentan orbitales f (f1 al f14) en su último nivel de energía.
Naturaleza de los Elementos
Gases Nobles
- Columna 18 en la tabla periódica.
- Grupo VIII o 0.
- Se caracterizan por tener todos sus niveles electrónicos completos.
- Configuración electrónica del tipo ns2p6, ns2 (Helio).
- En condiciones normales son químicamente inertes (muy poco reactivos).
Elementos Metalicos
- Son casi todos sólidos (a temperatura ambiente), a excepción del Mercurio, Cesio y Rubidio.
- Son muy buenos conductores de la corriente eléctrica.
- Pierden electrones con facilidad, transformándose en cationes estables.
- Poseen brillo metálico y son muy buenos conductores de calor.
- Son dúctiles, lo que permite que bajo la acción de una fuerza puedan deformarse sin romperse.
- Son maleables, es decir, su capacidad de deformación permite su uso para la confección de láminas.