Introducción
| Categoría de salinidad | S |
| Hiperhalina | > 65 |
| Metahalina | 45-65 |
| Euhalina | 30-35 |
| Polifalina | 18-30 | Mesohalina | 5-18 |
| Oligohalina | .5-5 |
La salinidad del agua de mar se define como la cantidad total en peso de sales disueltas en un kilogramo de agua de mar. La salinidad se expresa en la unidad g / kg, que a menudo se escribe como ppt (parte por mil) o ‰ (permil). Las sales disueltas en el agua de mar se disocian en sus iones; los iones predominantes son el cloruro y el sodio; otros iones significativos son el magnesio, el sulfato, el calcio y el potasio. A lo largo de los años, se han desarrollado varios métodos para determinar la salinidad. El método más práctico utilizado actualmente es el de la conductividad eléctrica. Dado que se trata de un método indirecto, se ha establecido una relación precisa entre la conductividad y la salinidad. La salinidad determinada de este modo es una cantidad adimensional que se denomina salinidad práctica. Según la escala de salinidad práctica, el agua de mar típica «estándar» tiene una salinidad de 35. Para lograr una mayor coherencia con la termodinámica del agua de mar, en 2010 se introdujo una nueva escala de salinidad, la llamada escala de salinidad absoluta. La pequeña corrección numérica de la escala de salinidad práctica que esto supone no tiene gran importancia práctica para las aguas costeras, donde queda empequeñecida por la fuerte variabilidad de la salinidad en el espacio y el tiempo. Sin embargo, es necesaria una gran precisión para el océano, porque las pequeñas diferencias de salinidad pueden ser muy relevantes para la circulación oceánica a gran escala y la caracterización de las masas de agua.
El agua de mar es más densa que el agua dulce debido al peso añadido de las sales disueltas; la relación entre salinidad y densidad se trata en el artículo Densidad del agua de mar). Este artículo ofrece una visión general de las diferentes escalas de salinidad. Los sensores utilizados para medir la conductividad se tratan en el artículo Sensores de salinidad.
Mediciones y definiciones de la salinidad a lo largo de la historia
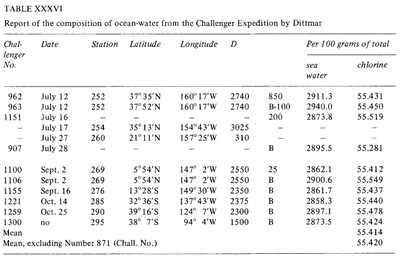
Composición constante del agua de mar (Dittmar, 1884)
Desde los tiempos de la antigua Grecia, se ha intentado medir la «salinidad» del agua de mar. Sin embargo, estos primeros métodos no eran muy eficaces y su sensibilidad y repetibilidad eran muy limitadas. Durante la Historia Moderna se desarrollaron metodologías más precisas: pesaje tras evaporación (Boyle, 1693; Birch, 1965), extracción con disolventes (Lavoisier, 1772) y precipitación (Bergman, 1784). En 1865, Forchhammer introdujo el término salinidad y se dedicó a medir los componentes individuales de la sal marina en lugar de la salinidad total. Descubrió que la proporción de sales principales en muestras de agua de mar de diversos lugares era constante. Esta proporción constante se conoce como el Principio de Forchhammer, o el Principio de las Proporciones Constantes. Hacia finales del siglo XIX, William Dittmar, siguiendo los trabajos de Forchhammer, probó varios métodos para analizar la salinidad y la composición química del agua de mar. Los métodos de Dittmar para el análisis químico del agua de mar eran extremadamente precisos. Dittmar analizó el contenido de cloro del agua de mar mediante la precipitación del cloruro con nitrato de plata y lo comparó con muestras de agua de mar preparadas sintéticamente para evaluar la precisión del método. Posteriormente analizó 77 muestras de todo el mundo, tomadas durante la Expedición Challenger, y observó la misma constancia en la composición observada por Forchhammer: «aunque la concentración de las aguas es muy diferente, la composición porcentual del material disuelto es casi la misma en todos los casos». .
Definición de salinidad 1902
Con las técnicas más precisas para medir la salinidad, era necesario tener la misma definición de salinidad y métodos de medición en toda la comunidad científica. En 1889, Martin Knudsen fue nombrado por el CIEM para presidir una comisión que abordara los problemas de salinidad. Formuló la siguiente definición:
«La salinidad es la cantidad total de materiales sólidos, en gramos, disueltos en un kilogramo de agua de mar cuando todo el carbonato se ha convertido en óxido, el bromo y el yodo se han sustituido por cloro y toda la materia orgánica se ha oxidado completamente.
Aunque esta definición es correcta y sirvió a los oceanógrafos durante los siguientes 65 años, la metodología es poco práctica y difícil de llevar a cabo con precisión. Sabiendo que los iones principales permanecen en proporciones constantes entre sí y que el cloro puede medirse con precisión mediante una valoración volumétrica con plata, la comisión definió la «clorinidad» como una medida de la salinidad. Originalmente, la salinidad se calculaba a partir del contenido de Cl- (clorinidad). La clorinidad se mide como la masa en g de haluros que pueden precipitarse a partir de 1.000 g de agua de mar mediante Ag+ utilizando una solución estándar de AgNO3. La reacción es:
AgNO3 (aq) + NaCl (aq) → AgCl(s) + NaNO3 (aq)
Después de analizar un gran número de muestras de nueve lugares, Knudsen y sus colegas desarrollaron una ecuación para calcular la salinidad en función del contenido de cloro:
S = 1,805 \, Cl^- + 0,03 \; g / kg , \qquad (1)
donde la clorinidad Cl- se define como la masa de plata necesaria para precipitar completamente los halógenos en 0,3285234 kg de la muestra de agua de mar:
Cl- = 328.5234 Ag+
Las medidas de salinidad se expresan a veces en la escala de clorinidad (g Cl- / kg) o en la escala de clorosidad (g Cl- / l).
Definición de salinidad revisada 1966
Como se ve en la fórmula (1), este método tiene sus limitaciones y no es del todo correcto: cuando la clorinidad es 0, la salinidad es 0,03. Además, Carritt y Carpenter (1959) han estimado que la incertidumbre de un valor calculado de salinidad a partir de un valor medido de clorinidad utilizando esta relación puede ser de hasta 0,04 g / kg. Esto se debe a las variaciones en la composición química de algunas muestras de agua de mar (Báltico) y al hecho de que sólo se tomaron muestras en 9 lugares diferentes para definir la clorinidad.A principios de los años 60, con el desarrollo de los puentes de conductividad, se hizo posible medir la salinidad con gran precisión (± 0,003 g / kg). Los puentes daban relaciones de conductividad entre la muestra y el agua de mar estándar utilizada para calibrar los puentes. Sin embargo, el agua de mar estándar se había desarrollado para las mediciones de clorinidad y no para la conductividad, por lo que se encargó un nuevo estándar de conductividad al Joint Panel for Oceanographic Tables and Standards (JPOTS). Basándose en las nuevas mediciones de salinidad, temperatura y conductividad de muestras de todo el mundo, la fórmula permanente de la clorinidad se revisó a:
S = 1,80655 \Ncl^- . \qquad (2)
Escala Práctica de Salinidad-1978 / EOS-80
¿Qué es la PSU? por Frank J. Millero en la revista Oceanography, 1993
Después de recibir el último número de Oceanography, me irritó el anuncio de Sea-Bird en la portada interior. Muestra un diagrama de TS que está etiquetado con el término PSU. Aunque no he conseguido que la empresa deje de utilizar este término, pensé que debía escribir esta carta para expresar mi preocupación por su uso por parte de los oceanógrafos en los artículos publicados. El término aparentemente se utiliza para denotar el uso de la Escala Práctica de Salinidad y es una abreviatura de Unidad Práctica de Salinidad.Como miembro del Panel Conjunto de Tablas y Estándares Oceanográficos que fue instrumental en el desarrollo de la ecuación internacional del estado del agua de mar y la escala práctica de salinidad, me sorprende que la práctica que parece haber sido adoptada por los oceanógrafos en el uso de PSU. La escala práctica de salinidad se definió como relación de conductividad sin unidades. Una muestra de agua de mar con una relación de conductividad de 1,0 a 15ºC con una solución de KCl que contiene una masa de 32,4356 g en una masa total de 1 kg de solución tiene una salinidad de 35.000 (no se necesitan unidades ni ‰). La dependencia de la salinidad y la temperatura de esta relación para el peso del agua de mar evaporada o diluida con agua condujo a la definición completa de la escala de salinidad práctica. Esta definición fue adoptada por todas las organizaciones oceanográficas nacionales e internacionales. En algún momento, los oceanógrafos empezaron a utilizar el término PSU (unidad de salinidad práctica) para indicar que la escala de salinidad práctica se utilizaba para determinar la salinidad por conductividad. Al parecer, esto se debió al uso anterior de ‰ para representar partes por mil, que algunos oceanógrafos consideraban una unidad. La conclusión es que la salinidad siempre ha sido una relación y no tiene unidades físicas. El uso del término PSU no debería permitirse en el campo y, desde luego, no debería utilizarse en los artículos publicados. Siempre que se utilice la escala práctica de salinidad para determinar la salinidad, debe indicarse en algún lugar del documento. El uso del término PSS puede utilizarse para indicar que se utiliza la Escala Práctica de Salinidad. Por supuesto, no es necesario utilizar el término PSU en todas las figuras que muestren datos de TS. También debo señalar que la UNESCO (1985) ha publicado un informe de SUN en el que se describe cuidadosamente el uso de las unidades en el campo de la oceanografía. Este informe también fue adoptado por todas las Sociedades Oceanográficas Internacionales, pero no es utilizado generalmente por los oceanógrafos y las revistas que publican datos oceanográficos. Si el campo de la oceanografía quiere convertirse en una ciencia reconocida, debe adoptar las unidades que son básicas en los campos de la química y la física. Tampoco debe adoptar nuevas unidades para las variables que no tienen unidades.
La relación de peso de las distintas sales disueltas en el agua de mar es casi la misma en todos los océanos del mundo. Esto también es válido para las aguas costeras, aunque las desviaciones de la composición estándar se vuelven más importantes a baja salinidad en la zona de transición sal-fresca. Debido a la composición aproximadamente universal de las sales disueltas en el agua de mar, la salinidad del agua de mar puede derivarse del grado de dilución del agua de mar con agua dulce. Esto se hace más convenientemente midiendo la conductividad C. La Escala Práctica de Salinidad (PSS) se introdujo para establecer una relación unívoca entre la salinidad y la conductividad. Esta relación se basa en la relación R de la conductividad del agua de mar y la conductividad C(35,15) de una solución estándar de 1 kg que contiene 32,4356 g de KCl a 15oC, que tiene una salinidad S=35.
La relación entre la salinidad S(T) y la relación de conductividad R=R(S,T) se basó en determinaciones precisas de la clorinidad y la relación de conductividad para diferentes temperaturas T en 135 muestras de agua de mar natural, todas ellas recogidas a menos de 100 m de la superficie, e incluyendo muestras de todos los océanos y de los mares Báltico, Negro, Mediterráneo y Rojo. Después de convertir la clorinidad en salinidad, utilizando la relación (2), se calculó el siguiente polinomio por mínimos cuadrados :
S(T) = S(15) + \Delta S(T) , \qquad R=\Large\frac{C(S,T)}{C(35,15)}\normalsize , \qquad (3)
S(15)=0,008-0.1692,R^{1/2}+25,3851,R+14,0941,R{3/2}-7,0261,R^2+2,7081,R^{5/2} , \qquad (4)
Delta S(T)= \Large\frac{T-15}{1+0.0162(T-15)}\normalsize (0.0005-0.0056\,R^{1/2} \\ -0.0066\,R-0.0375\,R^{3/2}+0.0636\,R^2-0.0144\,R^{5/2}) , \qquad (5)
para 2 \, \le S \le, 42 y para la presión atmosférica,
S(15) \\\a aproximado 0,586 \a, C^{1,0876} , donde C se expresa en mS/cm.
Sin embargo, dado que la conductividad absoluta no puede medirse con la exactitud necesaria para realizar mediciones precisas de la salinidad, es aconsejable utilizar la conductividad medida en relación con la del agua de mar estándar y aplicar las relaciones salinidad-conductividad (3-5).
La Escala Práctica de Salinidad fue adoptada en 1980 como norma internacional para la oceanografía por el Panel Conjunto UNESCO/SCOR/ICES/IAPSO sobre Tablas y Normas Oceanográficas y el Grupo de Trabajo 51 del SCOR (JPOTS). La correspondiente Ecuación de Estado del Agua de Mar (EOS-80) basada en la escala de temperatura IPTS-68 y en la Escala Práctica de Salinidad 1978, PSS-78 (Lewis y Perkin, 1981) fue publicada por Millero et al. (1980).
TEOS-10
La COI de la UNESCO introdujo en 2010 una nueva definición de salinidad, la denominada Salinidad Absoluta S_A. La Ecuación de Estado Termodinámica (TEOS) se actualizó por varias razones :
- Varias de las expresiones polinómicas de la Ecuación Internacional de Estado del Agua de Mar (EOS-80) no son totalmente consistentes entre sí ya que no obedecen exactamente a las relaciones termodinámicas de diferenciación cruzada de Maxwell. El nuevo enfoque elimina este problema.
- Desde finales de los años 70 ha aparecido una descripción termodinámica más precisa del agua pura (IAPWS-95). También se han realizado más mediciones, y bastante precisas, de las propiedades del agua de mar (como por ejemplo para (i) la capacidad térmica, (ii) la velocidad del sonido y (iii) la temperatura de máxima densidad) y pueden incorporarse a una nueva descripción termodinámica del agua de mar.
- Se ha llegado a comprender mejor el impacto que tiene en la densidad del agua de mar la variación de la composición del agua de mar en las diferentes cuencas oceánicas.
- El creciente énfasis en el océano como parte integral del motor térmico global apunta a la necesidad de expresiones precisas para la entalpía y la energía interna del agua de mar, de modo que los flujos de calor puedan determinarse con mayor precisión en el océano (la entalpía y la energía interna no estaban disponibles en el EOS-80).
- Se ha revisado la escala de temperatura de ITS-68 a ITS-90 y se han revisado los pesos atómicos de los elementos.
- Para otros artículos de este autor ver Categoría:Artículos de Souza Dias, Francisco
- Para otros artículos de este autor ver Categoría:Artículos de TÖPKE, Katrien
- Para un resumen de las contribuciones de este autor ver Especial:Contribuciones/Francisco Souza Dias
- Para un resumen de las contribuciones de este autor ver Especial:Contribuciones/Ktopke
La Salinidad Absoluta S_A se define como la fracción de masa de material disuelto no H2O en una muestra de agua de mar a su temperatura y presión y se expresa en unidades g / kg. Por lo tanto, también se denomina Salinidad de la Densidad. La fracción de masa de H2O en una muestra de agua de mar viene dada, pues, por 1-0,001 S_A. Esta definición aborda correctamente la cuestión de «qué constituye el agua y qué constituye el material disuelto» (por ejemplo, la disolución de una masa dada de CO2 en agua pura transforma esencialmente parte del agua en material disuelto porque produce una mezcla de CO2, H2CO3, HCO3-, CO32-, H+, OH- y H2O, con las proporciones relativas que dependen de las constantes de disociación que dependen de la temperatura, la presión y el pH.).
Los valores de la Salinidad Absoluta S_A difieren sólo ligeramente de los valores correspondientes de la Salinidad Práctica S. Para el agua de mar de composición estándar de referencia
S_A = \Large\frac{35,16504}{35}\normalsize S \; g / kg \qquad (6).
En otras palabras, para una muestra de agua de mar de referencia con Salinidad Práctica 35 la Salinidad Absoluta es 35,16504 g / kg. Para el agua de mar no estándar recogida en lugares arbitrarios del océano, la diferencia media entre la Salinidad Absoluta S_A y la Ecuación (6) es de aproximadamente 0,0107 g / kg. Se sabe que el valor de la Salinidad Absoluta S_A expresado en g / kg y el valor correspondiente de la Salinidad Práctica S no difieren en más de un 0,5%. El uso de la Salinidad Práctica tiene la ventaja de que se determina (casi) directamente a partir de mediciones de conductividad, temperatura y presión, mientras que la Salinidad Absoluta se deriva generalmente de una combinación de estas mediciones más otras mediciones y correlaciones que a menudo no están bien establecidas.
Impacto biológico de la salinidad

La ósmosis a través de una membrana semipermeable que permite que las moléculas de agua (azul) pasen más fácilmente que las moléculas de sal (rojo). A través de la membrana pasan más moléculas de agua hacia el compartimento de agua de mar que moléculas de sal hacia el compartimento de agua dulce, hasta que la concentración de sal es igual en ambos lados de la membrana. Esto aumenta la presión en el compartimento de agua de mar, la llamada presión osmótica. Adaptado de ZME Science.
Todos los organismos tienen que mantener un equilibrio entre el agua y los solutos en sus cuerpos para mantener sus células vivas. Esto se llama homeostasis. Para regularlo, pueden importar y exportar solutos a través de sus membranas, que son permeables a las sustancias disueltas o suspendidas en el agua. El movimiento aleatorio de las sustancias disueltas a través de una membrana permeable se llama difusión. La difusión se produce hasta que las concentraciones son iguales a ambos lados de la membrana. Cuando un soluto no puede atravesar la membrana, la igualdad de concentraciones en ambos lados se consigue mediante el movimiento neto del agua a través de la membrana. El movimiento neto de agua a través de una membrana semipermeable en respuesta a las diferencias de concentración de solutos se denomina «ósmosis». Esto es esencial para la supervivencia de la célula. En caso de que la concentración de sal en el exterior sea mayor que en el interior, la célula perderá agua, se deshidratará y morirá. En el caso contrario, la célula absorberá agua, se hinchará y posiblemente reventará. Por esta razón, los organismos invierten tiempo y energía en mantener la homeostasis.
Sensores de salinidad Densidad del agua de mar Intrusión y mezcla del agua de mar en los estuarios Circulación estuarina Estuarios de cuña salina Intercambio del mar de la plataforma con el océano
Por favor, tenga en cuenta que otras personas también pueden haber editado el contenido de este artículo.