Introduzione
La broncopneumopatia cronica ostruttiva (BPCO) è una grave patologia polmonare, lentamente progressiva con ripercussioni sistemiche; colpisce principalmente persone di oltre 40 anni.1 Tuttavia, la BPCO è prevenibile e curabile. Molti pazienti sperimentano esacerbazioni della BPCO e alcuni di questi richiedono visite al pronto soccorso (ER) e ricoveri. In Portogallo, anche se i ricoveri dovuti alla BPCO tra il 2009 e il 2016 sono diminuiti dell’8%, essi rappresentano ancora 8049 pazienti ricoverati nel 2016. I ricoveri di pazienti di 80 anni o più sono aumentati dal 28,4% nel 2005 al 38,0% nel 2014, riflettendo una popolazione che invecchia,2 con potenzialmente più comorbidità.
La gestione appropriata delle esacerbazioni della BPCO rappresenta un’importante sfida clinica.3 Nel 70-80% delle esacerbazioni della BPCO, il fattore precipitante è un’infezione del tratto respiratorio,4 ma in circa un terzo delle esacerbazioni gravi della BPCO non è possibile identificare una causa,1 il che ostacola una corretta guida della strategia terapeutica. Esistono diversi strumenti diagnostici per valutare un’esacerbazione e la sua gravità, che aiuteranno a decidere se il paziente può essere gestito a casa o in un contesto di cure primarie o se deve essere indirizzato a un pronto soccorso ed eventualmente ricoverato.1,5-7 La gravità di un’esacerbazione informerà il suo trattamento,1,7,8 e i punteggi prognostici dovrebbero essere utilizzati per prevedere il rischio di una futura esacerbazione. Sono stati proposti tre punteggi prognostici basati sulle caratteristiche biologiche e cliniche delle esacerbazioni: il punteggio BAP-65,9 il punteggio DeCOPD9 e il punteggio proposto da Roche et al.10,11
Dopo un’esacerbazione gestita in modo appropriato, dovrebbe essere preparato un piano di dimissione adeguato. Questo dipenderà dalla gravità dell’esacerbazione, ma dovrebbe generalmente includere la riclassificazione del paziente secondo i criteri GOLD,1 l’ottimizzazione della terapia farmacologica,1,4,8 la gestione delle comorbidità, l’educazione del paziente (o di chi lo assiste a casa) sull’uso corretto dei farmaci,1,8 il rinvio a un consulto pneumologico se non ne sta già frequentando uno, e un programma di cessazione del fumo e riabilitazione polmonare.
EsacerbazioniDefinizione, cause ed eziologiaDefinizione
Al momento non esiste una definizione esatta o coerente di esacerbazione della BPCO. La definizione di esacerbazione nell’aggiornamento GOLD del 2016,12 “un evento acuto caratterizzato da un peggioramento dei sintomi respiratori del paziente che va oltre le normali variazioni giornaliere e porta a un cambiamento dei farmaci”, è stata semplificata nel documento GOLD 201713 in “un peggioramento acuto dei sintomi respiratori che comporta una terapia aggiuntiva”.
Cause ed eziologia
Sono stati identificati diversi fattori che possono portare a un peggioramento dei sintomi, e nel 70-80% dei casi di esacerbazione della BPCO, il fattore precipitante è un’infezione del tratto respiratorio,4 sia virale4,9,14,15 che batterica,4,9,15 ma in circa un terzo delle esacerbazioni gravi della BPCO non è possibile identificare una causa.1
È importante identificare la causa di fondo di un’esacerbazione in quanto ciò guiderà la strategia terapeutica.
Classificazione
Come la mancanza di una definizione di esacerbazione, non esiste un sistema di classificazione consensuale per valutare la gravità dell’esacerbazione, sebbene ne siano stati proposti alcuni.16 Alcuni di questi punteggi saranno discussi più avanti.
Nelle esacerbazioni lievi c’è un peggioramento dei sintomi che può essere gestito a casa, con un aumento del dosaggio dei farmaci regolari.1,6,17 Le esacerbazioni moderate non rispondono ad un aumento del dosaggio dei broncodilatatori e quindi richiedono un trattamento con corticosteroidi sistemici e/o antibiotici.1,6,17,18 Le esacerbazioni gravi richiedono l’ospedalizzazione o la valutazione al pronto soccorso1,6,17,18 e hanno un grave impatto sull’attività fisica. Le esacerbazioni molto gravi richiedono il ricovero in un’unità di terapia intensiva (ICU)1 e hanno un impatto molto grave sull’attività fisica. Le esacerbazioni infettive sono caratterizzate da aumenti di volume e purulenza dell’espettorato associati a dispnea aggravata e devono essere trattate con antibiotici.1,8
Strumenti diagnostici
La valutazione di un’esacerbazione e della sua gravità si basa sulla storia medica del paziente,1,6 per esempio, la limitazione del flusso aereo, la durata del peggioramento dei sintomi e il numero di episodi precedenti (totale/ospedalizzazioni). Sintomi come dispnea, tosse o espettorato,7 livelli di saturazione dell’ossigeno,7 nuova limitazione delle attività quotidiane,6,7 segni clinici di gravità come l’uso dei muscoli respiratori accessori,1,5 movimenti paradossali della parete toracica,1,5 peggioramento o nuova comparsa della cianosi centrale,1,7 sviluppo di edema periferico,1,7 instabilità emodinamica,1 stato mentale deteriorato1,6,7 e comorbidità1 devono essere tutti valutati. La pulsossimetria deve essere eseguita su tutti i pazienti.6 Se un paziente viene indirizzato a un ospedale, devono essere misurati i gas ematici arteriosi5,6,8,15,19-21 e deve essere eseguita una radiografia del torace per escludere comorbidità e/o altre malattie polmonari.1,6,8,15,19 In questi casi, si raccomanda anche di sottoporre i pazienti a un ECG,1,6,19,20 all’emocromo completo,1,6,8,20-22 e ai test biochimici di base, comprese le concentrazioni di elettroliti,1,8,20,21 l’urea,8 la glicemia1,20 e il pannello metabolico.6 I livelli di teofillina dovrebbero essere misurati nei pazienti in terapia con teofillina all’ammissione e le emocolture dovrebbero essere prese se il paziente ha la febbre.8 La coltura dei campioni di espettorato non è raccomandata nella pratica di routine, solo se l’espettorato è purulento,8 e il documento GOLD 2018 raccomanda la coltura dell’espettorato e un test di sensibilità antibiotica solo se una esacerbazione infettiva non risponde al trattamento antibiotico empirico.1 Alcuni autori menzionano l’emocromo per l’eosinofilia come procedura consigliabile per guidare la terapia delle esacerbazioni della BPCO, poiché è stato suggerito che le esacerbazioni eosinofile possono essere più reattive agli steroidi sistemici.1,15 La spirometria non è raccomandata durante un’esacerbazione.1
Se l’esacerbazione è grave e il paziente è ricoverato, si dovrebbero considerare i livelli di peptide natriuretico cerebrale e le misure degli enzimi cardiaci, soprattutto se il paziente non risponde al trattamento convenzionale.6 Inoltre, il tampone faringeo o l’espettorato dovrebbero essere testati per virus e batteri14,20,23 e la proteina C-reattiva del siero dovrebbe essere misurata.14,20,24 La procalcitonina può guidare la terapia antibiotica poiché è stata suggerita come un marcatore più specifico per le infezioni batteriche e può essere utile per decidere la prescrizione di antibiotici.1 L’indice di comorbidità Charlson,5,20,21,23 la scala di dispnea modificata del Medical Research Council (mMRC),5,20,21,23 l’attività fisica5 e la salute generale5 dovrebbero essere valutati. Gli autori non consigliano l’uso del punteggio del COPD Assessment Test (CAT)23 di routine in Portogallo, in quanto non è validato per la popolazione portoghese. Se il paziente viene ricoverato in terapia intensiva, oltre ai test raccomandati nelle esacerbazioni gravi, si dovrebbe usare la Glasgow Coma Scale5 , indagare le infezioni del tratto respiratorio25 ed eseguire un’emocoltura.24 Secondo il documento GOLD 2018 solo i pazienti che richiedono una ventilazione non invasiva (NIV) o una ventilazione invasiva (IV) dovrebbero essere ricoverati.1
Strategie farmacologicheLABA+LAMA
Gli agonisti β2 per via inalatoria a breve durata d’azione (SABA) e gli antagonisti muscarinici a breve durata d’azione (SAMA) rimangono la colonna portante nel trattamento dei sintomi e dell’ostruzione del flusso aereo durante le esacerbazioni della BPCO.1,4,6 Anche se al momento della pubblicazione del documento GOLD 2018 non esistevano studi clinici che valutassero l’utilità dei β2 agonisti a lunga durata d’azione (LABA) o degli antagonisti muscarinici a lunga durata d’azione (LAMA) nelle esacerbazioni, la raccomandazione è di continuare questo farmaco durante l’esacerbazione o di iniziarlo il prima possibile prima della dimissione dall’ospedale.1 La combinazione LABA+LAMA ha un beneficio documentato nella riduzione delle riacutizzazioni quando viene prescritta a pazienti nella fase stabile della BPCO,26 in particolare la combinazione indacaterolo/glicopirronio come dimostrato negli studi SPARK27 e FLAME28. Inoltre, il recente studio FLAME28 , il primo studio prospettico che valuta l’eosinofilia nel sangue come biomarcatore della risposta terapeutica, ha dimostrato che l’indacaterolo/glicopirronio ha dimostrato un miglioramento significativo della funzione polmonare rispetto a salmeterolo/fluticasone per tutti i cutoff analizzati.29 Una recente analisi post hoc dello studio WISDOM ha identificato un sottogruppo di pazienti – pazienti con ≥2 esacerbazioni e ≥400 cellule/μL – che sembrano essere a maggior rischio di esacerbazione quando si sospende l’ICS.30 Infatti, e secondo la versione più recente del documento GOLD,1 i pazienti sintomatici nella fase stabile della BPCO e una storia di ≥2 esacerbazioni moderate, o 1 con ricovero, nell’ultimo anno, possono beneficiare di un ICS in aggiunta a LABA/LAMA. Tuttavia, è ancora da stabilire se gli eosinofili nel sangue possano essere utilizzati come biomarcatore per prevedere l’efficacia degli ICS in termini di prevenzione delle esacerbazioni, come suggerito dall’analisi post hoc WISDOM.1
Antibiotici, corticosteroidi e xantine
Quando si tratta un’esacerbazione si raccomanda di aggiungere corticosteroidi e/o antibiotici per via orale o endovenosa, a seconda della gravità dei sintomi e della presenza di un’infezione.1,4,6-8,31 Gli antibiotici dovrebbero essere usati solo per il trattamento di esacerbazioni infettive4,6,8,31 o gravi.31 I documenti GOLD 2018 e NHS 2014 raccomandano gli antibiotici per i pazienti con riacutizzazioni della BPCO che hanno tre sintomi cardinali – aumento della dispnea, volume dell’espettorato e purulenza dell’espettorato7 (Evidenza B)1; hanno due dei sintomi cardinali, se l’aumento della purulenza dell’espettorato è uno dei due sintomi7 (Evidenza C)1; o richiedono la ventilazione meccanica (invasiva o non invasiva) (Evidenza B).1
È stato dimostrato che gli antibiotici riducono il rischio di mortalità a breve termine, di fallimento del trattamento e di purulenza dell’espettorato, e uno studio su pazienti con BPCO con esacerbazioni che richiedono la ventilazione meccanica (invasiva o non invasiva) ha indicato che il mancato trattamento con antibiotici era associato a una maggiore mortalità e a una maggiore incidenza di polmonite nosocomiale secondaria.1 Una revisione Cochrane ha concluso che gli antibiotici per le esacerbazioni molto gravi della BPCO hanno mostrato effetti benefici ampi e consistenti in tutti gli esiti dei pazienti ricoverati in un’unità di terapia intensiva,32 ma questa conclusione era basata sui dati di un singolo studio.32
Il protocollo del NHS per la gestione delle esacerbazioni della BPCO nell’assistenza primaria afferma che i broncodilatatori e i corticosteroidi sono il pilastro del trattamento delle esacerbazioni.7 Tuttavia, una revisione sistematica di 19 linee guida sulla BPCO ha riportato che i criteri per trattare i pazienti con antibiotici erano in gran parte basati su un aumento dei sintomi respiratori, mentre i corticosteroidi sistemici erano spesso universalmente raccomandati per tutti i pazienti con esacerbazioni acute.33 Gli autori hanno anche concluso che le attuali linee guida sulla BPCO sono di scarso aiuto nell’identificare i pazienti con esacerbazioni acute che potrebbero beneficiare del trattamento con corticosteroidi sistemici e antibiotici nelle cure primarie, il che potrebbe contribuire a un uso eccessivo o inappropriato di entrambi i trattamenti.
Alcuni biomarcatori sono stati suggeriti come utili per ottimizzare il trattamento antibiotico. Il documento GOLD 20181 non raccomanda l’uso di routine della CRP, ma afferma che diversi studi hanno suggerito che il trattamento antibiotico guidato dalla procalcitonina riduce l’esposizione agli antibiotici e gli effetti collaterali a parità di efficacia clinica. Questa osservazione è corroborata da una revisione Cochrane che dimostra che la procalcitonina può guidare la terapia antibiotica.32 Al contrario, altri autori hanno riferito che la CRP potrebbe essere un marcatore più valido,34 e uno studio reale di assistenza primaria ha concluso che l’esecuzione di test rapidi della CRP ha portato i medici generici a prescrivere meno antibiotici di quelli che non lo facevano.35
Per tutti i pazienti, la scelta dell’antibiotico deve essere guidata dal modello di resistenza batterica locale,1,8 dalla storia microbiologica del paziente e dai suoi fattori di rischio.
Di solito il trattamento empirico iniziale comprende l’aminopenicillina con acido clavulanico, un macrolide o una tetraciclina.1,8 Tuttavia, l’uso a lungo termine dei macrolidi può essere associato a importanti effetti collaterali e al rischio di sviluppare resistenza batterica.36 L’espettorato dovrebbe essere inviato per la coltura (nel caso di pazienti con frequenti esacerbazioni, grave limitazione del flusso aereo e/o esacerbazioni che richiedono la ventilazione meccanica1), poiché possono essere presenti batteri gram-negativi (per esempio, specie Pseudomonas) o patogeni resistenti che non sono sensibili agli antibiotici sopra menzionati.1
Anche se la durata del trattamento più efficace è ancora da definire,32 la durata raccomandata della terapia antibiotica è di solito 5-7 giorni (Evidenza D)1 ma la durata del trattamento dipenderà dall’antibiotico usato.
La gestione delle esacerbazioni nelle cure primarie dovrebbe includere la massimizzazione della terapia con broncodilatatori e corticosteroidi sistemici se non controindicati (prednisolone 30mg) per 7 giorni.1,7,8 La terapia con prednisolone orale è altrettanto efficace della somministrazione endovenosa.1 Il documento GOLD 2018 raccomanda una dose di 40mg di prednisone al giorno per 5 giorni1 mentre il NICE 2016 raccomanda una dose di 30mg per 7-14 giorni, e raccomanda inoltre che un ciclo di trattamento con corticosteroidi non dovrebbe essere più lungo di 14 giorni in quanto non vi è alcun vantaggio nella terapia prolungata.8 L’uso di corticosteroidi sistemici nelle esacerbazioni della BPCO ha dimostrato di abbreviare i tempi di recupero, migliorare la funzione polmonare, migliorare l’ossigenazione, diminuire il rischio di ricadute precoci e il fallimento del trattamento, e diminuire la durata dell’ospedalizzazione.1
Una meta-analisi ha confermato che il tasso di successo del trattamento è aumentato con i corticosteroidi sistemici rispetto alla cura abituale delle esacerbazioni della BPCO. I corticosteroidi sembrano essere vantaggiosi per tutta la popolazione in termini di tasso di successo del trattamento.37
Alcuni studi suggeriscono che i corticosteroidi possono essere meno efficaci nel trattamento delle esacerbazioni acute della BPCO nei pazienti con livelli più bassi di eosinofili nel sangue.15,38
Per quanto riguarda le metilxantine nella gestione delle esacerbazioni della BPCO, l’evidenza attuale non supporta il loro uso, dato che i possibili effetti benefici nella funzione polmonare e negli endpoint clinici sono modesti e inconsistenti, mentre gli eventi avversi sono significativi.1,4,6,31 Le metilxantine endovenose (teofillina o aminofillina) possono essere considerate una terapia di seconda linea e utilizzate come add-on quando la risposta è insufficiente. Quando si usa la teofillina, è necessario monitorare i livelli ematici, gli effetti collaterali e le potenziali interazioni farmacologiche.8,31
Terapia – stratificazione del rischio
Le esacerbazioni della BPCO possono essere classificate come lievi, moderate, gravi6 e molto gravi. Le esacerbazioni molto gravi richiedono il ricovero in terapia intensiva, con ventilazione invasiva, e non rientrano nello scopo di questo articolo.
Come già detto, le esacerbazioni della BPCO sono molto eterogenee e ciò rende particolarmente importante determinarne l’eziologia, la patologia, la gravità e il rischio, poiché tutti questi fattori avranno implicazioni sulla prognosi, sul trattamento farmacologico e sul luogo del trattamento.
In termini di trattamento farmacologico e luogo di trattamento, se le esacerbazioni sono lievi e non infettive,1,4,7,8,31 possono essere trattate a casa con un aumento del dosaggio dei broncodilatatori di mantenimento.6,17 Se l’esacerbazione è infettiva4,8,31 dovrebbe essere somministrato un antibiotico.1,7
Le esacerbazioni moderate dovrebbero essere trattate al pronto soccorso e il paziente poi dimesso, poiché queste esacerbazioni non richiedono il ricovero, a meno che il ricovero avvenga per motivi socioeconomici. Il dosaggio dei broncodilatatori di mantenimento dovrebbe essere aumentato6,17 e al paziente dovrebbe essere somministrato un corticosteroide orale6,17,18 per 5 giorni.1,38,39 Se l’esacerbazione è infettiva4,8,31 dovrebbe essere somministrato un antibiotico.1,7
Nel caso di un paziente che ha avuto un’esacerbazione grave, che richiede il ricovero, il paziente dovrebbe essere riclassificato come esacerbatore frequente. Di solito, l’ospedalizzazione a causa di una grave esacerbazione richiede la modifica del trattamento di mantenimento inalatorio che include O2 se il paziente è ipossiemico e ventilazione non invasiva se il paziente ha ipercapnia, maggiore di 52cm H2O e/o acidemia,1,4,6,8 corticosteroidi orali o endovenosi (per 5 giorni)1,38,39 e antibiotico se infettivo,1,7 xantine se c’è una risposta inadeguata al trattamento4,8,16,31 e prevenzione del tromboembolismo polmonare.
Dimissione – piano d’azione
I pazienti con esacerbazioni lievi dovrebbero essere rivalutati dopo tre mesi, con la spirometria e una rivalutazione del grado GOLD e, quando appropriato, la riclassificazione.
Alla dimissione da un’esacerbazione moderata, si dovrebbe ottimizzare la broncodilatazione, prescrivere la vaccinazione antipneumococcica e preparare un piano di cessazione del fumo e di riabilitazione respiratoria.
Alla dimissione dopo un’esacerbazione grave, si dovrebbe prescrivere una terapia di mantenimento ottimale1,4,8 con LABA, LAMA e ICS. I pazienti che hanno avuto un episodio di insufficienza respiratoria dovrebbero avere risultati soddisfacenti di ossimetria o gas sanguigni arteriosi prima della dimissione. I pazienti (o chi si prende cura di loro) devono ricevere informazioni appropriate che permettano loro di comprendere appieno l’uso corretto dei farmaci, compresi gli inalatori e l’ossigeno, e, se necessario, devono essere presi accordi per il follow-up e l’assistenza domiciliare (come l’infermiera in visita, la consegna dell’ossigeno, il riferimento ad altri supporti). Il paziente, chi si prende cura del paziente e il medico dovrebbero essere sicuri che il paziente possa gestire con successo il nuovo piano di trattamento. Quando c’è qualche dubbio sulla capacità del paziente di gestire la sua terapia, può essere utile una valutazione formale delle attività della vita quotidiana.8 Il documento GOLD 2018 fornisce un elenco di criteri di dimissione.1 Per i pazienti che sono ipossiemici durante un’esacerbazione, i gas del sangue arterioso e/o la pulsossimetria dovrebbero essere valutati prima della dimissione dall’ospedale e nei 3 mesi successivi. Se il paziente rimane ipossiemico, potrebbe essere necessaria una terapia con ossigeno supplementare a lungo termine.1 Inoltre, ai pazienti dovrebbero essere date chiare istruzioni su quando e come interrompere il trattamento con corticosteroidi.1,8 Per quanto riguarda la necessità di un’assistenza personalizzata, uno studio canadese in cui ai pazienti è stata offerta una telefonata dopo la dimissione, una visita a domicilio e un’assistenza continua ha concluso che, sebbene non ci fosse una riduzione dei tassi di riammissione a 30 e 90 giorni, è stata osservata una diminuzione della mortalità totale a 90 giorni. Questi dati suggeriscono che la cura individualizzata intrapresa in questo studio può avere un impatto sulla morbilità e mortalità della BPCO dopo un’esacerbazione acuta.40 Tutti i pazienti che hanno avuto una grave esacerbazione dovrebbero essere rivalutati 4-6 settimane dopo la dimissione dall’ospedale,1 ricevere una prescrizione di vaccinazione antipneumococcica, e dovrebbe essere preparato un piano di cessazione del fumo e di riabilitazione respiratoria – Fig. 1.
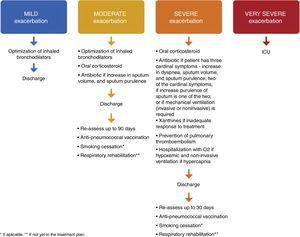
Terapia proposta, dimissione e follow-up delle esacerbazioni BPCO lievi, moderate, gravi e molto gravi.
Gli autori propongono che al paziente venga prescritto un vaccino antipneumocalcico 10-20 giorni dopo la dimissione dal Pronto Soccorso o dall’Ospedale.
Durante la consultazione di follow-up (tre mesi per le esacerbazioni moderate e 4-6 settimane per le esacerbazioni gravi), la spirometria e i gas sanguigni arteriosi dovrebbero essere misurati. I sintomi, l’uso corretto della terapia inalatoria e la gestione adeguata delle comorbidità dovrebbero essere rivalutati. Il trattamento farmacologico dovrebbe essere ottimizzato. Il piano di cessazione del fumo e di riabilitazione respiratoria dovrebbe essere valutato. Una nuova consultazione di follow-up dovrebbe essere programmata entro i prossimi 30-60 giorni.
Conclusioni
L’identificazione della causa sottostante alle esacerbazioni della BPCO e la valutazione della loro gravità è fondamentale per guidare il trattamento. Dopo che un’esacerbazione è gestita in modo appropriato, dovrebbe essere preparato un piano di dimissione adeguato che dipenderà dalla sua gravità. Un piano di dimissione adeguato ridurrà il carico dei sintomi, contribuirà a un recupero più rapido, aumenterà la qualità della vita del paziente e preverrà o ritarderà future esacerbazioni. Il rinvio a un consulto pneumologico, se il paziente non ne frequenta già uno, è della massima importanza.
Conflitti di interesse
AR dichiara di aver ricevuto compensi per parlare da AstraZeneca, Boehringer Ingelheim, Novartis, Bial, Medinfar, Mundipharma, Menarini, Grifols, Mylan, Tecnifar, Teva e cslbehring. CA dichiara di aver ricevuto parcelle da AstraZeneca, Pfizer, Novartis e Mundipharma. SF dichiara di non avere conflitti di interesse. JF dichiara di aver ricevuto parcelle da AstraZeneca, Boehringer Ingelheim, Diater, Inmunotek, Menarini, Mundipharma, Mylan, Tecnifar e TEVA, e di partecipare a comitati consultivi di Bial, GSK e Novartis. MD dichiara di aver ricevuto compensi per interventi da AstraZeneca, Boehringher Ingelheim, Bial, GSK, Menarini e Novartis e per la partecipazione a comitati consultivi di Bial, GSK e Novartis. CRC dichiara compensi per conferenze da Boehringer Ingelheim, Roche, Novartis, AstraZeneca, Pfizer vaccini, Teva, Menarini, Medinfar e Tecnifar, e la partecipazione a comitati consultivi di Boehringer Ingelheim, Roche, Novartis, GSK, AstraZeneca e Pfizer vaccini.