
Una femmina di polpo gigante del Nord Pacifico (Enteroctopus dofleini) vive da tre a quattro anni; depone migliaia di uova in un solo incontro e poi muore. Al contrario, un albero maturo di sequoia della costa (Sequoia sempervirens) vive per molte centinaia di anni e produce milioni di semi ogni anno (Figura 1). Come illustrano questi due esempi, gli organismi differiscono drasticamente nel modo in cui si sviluppano, il tempo che impiegano per crescere, quando diventano maturi, quanti figli di una particolare dimensione producono e quanto a lungo vivono. Insieme, i modelli di sviluppo, crescita, maturazione, riproduzione, sopravvivenza e durata della vita, specifici per età, dimensione o stadio, definiscono il ciclo di vita di un organismo, la sua storia di vita.

Lo scopo principale della teoria della storia della vita, una branca dell’ecologia evolutiva, è quello di spiegare la notevole diversità dei racconti di vita tra le specie. Ma c’è un’altra ragione, più convincente, per cui l’evoluzione della storia della vita è importante: l’adattamento per selezione naturale si basa sulla variazione della fitness darwiniana tra gli individui, e poiché i tratti della storia della vita determinano la sopravvivenza e la riproduzione, essi sono le componenti principali della fitness. Lo studio dell’evoluzione della storia della vita riguarda quindi la comprensione dell’adattamento, il problema più fondamentale della biologia evolutiva.
Introduciamo qui le basi della teoria della storia della vita e rivediamo ciò che i biologi hanno imparato sull’evoluzione della storia della vita. Per una trattazione più approfondita facciamo riferimento a Stearns (1992), Roff (1992, 2002), Charlesworth (1994), e Flatt e Heyland (2011). Si vedano anche gli articoli di Shefferson (2010), Young (2010), e Fabian e Flatt (2011) su Nature Education Knowledge.
Le basi della teoria della storia della vita
La teoria della storia della vita cerca di spiegare come la selezione naturale e altre forze evolutive modellano gli organismi per ottimizzare la loro sopravvivenza e riproduzione di fronte alle sfide ecologiche poste dall’ambiente (Stearns 1992, Roff 1992, Stearns 2000), o come ha recentemente detto David Reznick: “La teoria della storia della vita predice come la selezione naturale dovrebbe modellare il modo in cui gli organismi parcellizzano le loro risorse per fare figli” (Reznick 2010, p. 124). La teoria lo fa analizzando l’evoluzione dei componenti di fitness, i cosiddetti tratti della storia della vita, e come questi interagiscono: dimensioni alla nascita; modello di crescita; età e dimensioni alla maturità; numero, dimensioni e sesso della prole; sforzo riproduttivo specifico per età, stadio o dimensione; tassi di sopravvivenza specifici per età, stadio o dimensione; e durata della vita.
La teoria classica tratta l’evoluzione della storia della vita come un problema di ottimizzazione: dati particolari fattori ecologici (ad esempio, predatori, nutrizione) che influenzano la probabilità di sopravvivenza e riproduzione di un organismo, e dati vincoli limitanti e compromessi intrinseci all’organismo, quali sono i valori ottimali e le combinazioni dei tratti della storia della vita che massimizzano il successo riproduttivo? Per trovare la soluzione a questo problema dobbiamo capire le sue “condizioni al contorno” (Stearns 2000): (1) come i fattori ambientali estrinseci influenzano la sopravvivenza e la riproduzione; e (2) come le connessioni intrinseche tra i tratti della storia della vita (trade-off) e altri vincoli limitano se e come i tratti della storia della vita possono evolvere. Una volta che queste condizioni sono state comprese e definite, i modelli di storia della vita possono essere usati per rispondere a domande come: Quanto piccolo o grande dovrebbe crescere un organismo? A quale età e dimensione dovrebbe maturare? Quante volte dovrebbe riprodursi? Quanti figli dovrebbe produrre e di che dimensioni dovrebbero essere? Per quanto tempo dovrebbe riprodursi e quanto tempo dovrebbe vivere?
I problemi di ottimizzazione della storia di vita sono tipicamente modellati usando l’equazione di Euler-Lotka, che descrive il tasso di crescita della popolazione (cioè la fitness) di un genotipo clonale (o di una sostituzione allelica) nel tempo di una generazione continua in funzione della sua età alla maturità, dell’età all’ultima riproduzione, della probabilità di sopravvivenza specifica dell’età e del numero previsto di figli specifici dell’età (Stearns 1992, Roff, 1992, Brommer 2000):
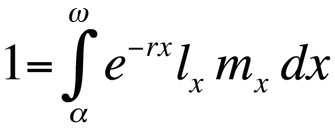
dove α è l’età alla prima riproduzione, ω l’età all’ultima riproduzione, lx la probabilità di sopravvivere dalla nascita alla classe di età x, mx il numero atteso di figli nella classe di età x, e r il tasso di crescita della popolazione o parametro malthusiano. L’equazione somma le probabilità di sopravvivenza e riproduzione per l’intera vita degli individui nella popolazione e può quindi essere risolta per r. Si noti che nel contesto della teoria della storia della vita r misura il tasso di crescita o la fitness di un clone o, negli organismi che si riproducono sessualmente, il tasso di diffusione di un allele che influenza la storia della vita. Quindi, l’assunzione implicita è che la popolazione modellata consiste di individui fenotipicamente e geneticamente identici. Se la popolazione descritta dall’equazione di Euler-Lotka è stazionaria (non in crescita), r è zero e l’equazione diventa
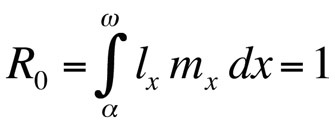
o, se il tempo di generazione è discreto,
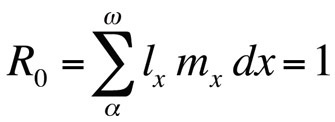
dove R0 è il numero atteso di figlie per femmina per tutta la vita (tasso riproduttivo netto). Questa equazione è più semplice della versione a tempo continuo e può essere usata ogni volta che r è zero o vicino a zero; per popolazioni stabili che non cambiano di dimensione, R0 è la misura di fitness appropriata (Stearns 1992, Roff 1992, Brommer 2000). Usando questa struttura, ci si può chiedere quale particolare combinazione di tratti della storia della vita massimizza il fitness, o quanto il fitness è influenzato quando uno dei tratti viene cambiato. Questo approccio è stato usato con grande successo per prevedere l’evoluzione dei tratti della storia della vita.
Variazione genetica per i tratti della storia della vita
L’evoluzione dei tratti della storia della vita da parte della selezione naturale dipende dalla variazione genetica sulla quale la selezione può agire per produrre adattamenti in risposta all’ambiente. I modelli menzionati sopra presuppongono implicitamente che l’evoluzione della storia della vita non sia limitata da una mancanza di variazione genetica. È interessante notare, tuttavia, che l’ereditabilità (h2 = VA/VP = varianza genetica additiva divisa per la varianza fenotipica), cioè la proporzione di differenze fenotipiche tra gli individui in una popolazione che è spiegata da differenze genetiche additive tra di loro, è solitamente piccola per i tratti della storia della vita. Questa bassa ereditabilità potrebbe essere causata da basse quantità di varianza genetica additiva; tuttavia, esiste un’ampia variazione genetica per i tratti della storia della vita nelle popolazioni naturali e di laboratorio. Coerentemente con la nozione che i componenti di fitness ospitano molte variazioni genetiche, molti esperimenti di selezione artificiale in laboratorio sono riusciti con successo a causare cambiamenti evolutivi nei tratti della storia della vita nella direzione prevista (Stearns 1992, Roff 1992, Houle 2001). Una ragione per la grande VA dei tratti della storia della vita può essere che sono tratti altamente complessi, quantitativi e poligenici influenzati da molti loci (Houle 1992).
Ma come possiamo conciliare il fatto che il VA è grande mentre allo stesso tempo h2 è piccolo? Una probabile ragione per la bassa ereditabilità dei tratti della storia della vita è che, sebbene VA (il numeratore) sia grande, VP (il denominatore) è molto più grande di VA. Si noti che la varianza fenotipica VP consiste in VA, la varianza genetica additiva, più un resto, VR, che consiste in tutte le fonti genetiche non additive di variazione (dovute a dominanza, epistasi, ecc.) e la variazione fenotipica generata dall’ambiente (cioè, plasticità fenotipica, interazioni genotipo-ambiente; vedi sotto). Quindi, i tratti della storia della vita hanno probabilmente una bassa ereditabilità perché sono influenzati da molti loci (il che gonfia sia VA che VP) mentre allo stesso tempo ospitano sostanziali quantità di variazione residua VR, per esempio la variazione dovuta ai cambiamenti nell’ambiente (che gonfia VP ma non VA) (Houle 1992, Houle 2001).
Inoltre, anche se i tratti della storia della vita sono sottoposti a una forte selezione, che dovrebbe esaurire la varianza genetica, diversi fattori possono mantenere la variazione genetica per questi tratti, tra cui l’equilibrio mutazione-selezione, l’eterogeneità ambientale e le interazioni genotipo-ambiente, e le correlazioni genetiche negative (Stearns 1992, Roff 1992, Houle 2001). Tuttavia, nonostante le grandi quantità di variazioni nella storia della vita, l’evoluzione della storia della vita è anche soggetta a vincoli.
Cambi di storia della vita e altri vincoli
L’idoneità sarebbe ovviamente massima se la sopravvivenza e la riproduzione fossero massime in tutte le età, fasi o dimensioni di un organismo. In linea di principio, quindi, il problema di base dell’evoluzione della storia della vita è banale: tutti i tratti della storia della vita dovrebbero sempre evolversi in modo da massimizzare la sopravvivenza e la riproduzione e quindi la fitness (Houle 2001). Questo porterebbe molto rapidamente all’evoluzione di “demoni darwiniani” (Law 1979) che conquisterebbero il mondo, cioè organismi che iniziano a riprodursi appena nati, producono un numero infinito di figli e vivono per sempre. Tali organismi, tuttavia, non esistono nel mondo reale: Le risorse sono finite e i tratti della storia della vita sono soggetti a compromessi intrinseci e altri tipi di vincoli, quindi la selezione naturale non può massimizzare i tratti della storia della vita – e quindi la fitness – oltre certi limiti. Chiamiamo tali limiti vincoli evolutivi (Stearns 1992, Houle 2001); come detto sopra, essi rappresentano la “condizione limite” intrinseca che dobbiamo comprendere per prevedere l’evoluzione della storia della vita.
Uno dei più importanti tipi di vincoli sono i trade-off della storia della vita (Stearns 1992, Roff 1992, Flatt e Heyland 2011). Un trade-off esiste quando un aumento in un tratto della storia della vita (migliorando la fitness) è accoppiato a una diminuzione di un altro tratto della storia della vita (riducendo la fitness), in modo che il beneficio della fitness attraverso l’aumento del tratto 1 è bilanciato da un costo della fitness attraverso la diminuzione del tratto 2 (Figura 2A). A livello genetico, si pensa che tali trade-off siano causati da alleli con effetti pleiotropici antagonisti o dal disequilibrio di linkage tra loci.
I trade-off sono tipicamente descritti da correlazioni fenotipiche o genetiche negative tra componenti di fitness tra individui in una popolazione (Figura 2A). Se la relazione è genetica, si prevede che una correlazione genetica negativa limiti (cioè rallenti o impedisca) l’evoluzione dei tratti coinvolti. Quindi, esiste un trade-off genetico in una popolazione quando un cambiamento evolutivo in un tratto che aumenta la fitness è legato a un cambiamento evolutivo in un altro tratto che diminuisce la fitness. L’esistenza di correlazioni genetiche può essere stabilita attraverso progetti di allevamento genetico quantitativo o attraverso risposte fenotipiche correlate alla selezione. Per esempio, la selezione artificiale diretta per l’estensione della durata della vita in popolazioni di laboratorio geneticamente variabili di moscerini della frutta (Drosophila melanogaster) causa l’evoluzione dell’aumento della durata della vita adulta (a volte in 10 o meno generazioni), ma questo aumento evolutivo della longevità è accoppiato alla diminuzione della riproduzione precoce (ad esempio, Zwaan et al. 1995). Questo suggerisce che la durata della vita e la riproduzione precoce sono geneticamente accoppiati negativamente, ad esempio attraverso alleli pleiotropici antagonisti (ad esempio, Flatt 2011, Fabian e Flatt 2011).
A livello fisiologico, i trade-off sono causati dall’allocazione competitiva di risorse limitate a un tratto della storia della vita rispetto all’altro in un singolo individuo, ad esempio quando gli individui con un maggiore sforzo riproduttivo hanno una durata di vita più breve o viceversa (Figura 2B). Un modo utile per pensare ai trade-off di allocazione delle risorse è quello di immaginare una storia di vita come una torta finita, con le diverse fette che rappresentano come un organismo divide le sue risorse tra crescita, immagazzinamento, mantenimento, sopravvivenza e riproduzione (Reznick 2010; Figura 2C). Il problema essenziale è questo: date le circostanze ecologiche e il fatto che aumentare una fetta significa ridurne un’altra, qual è il modo migliore per dividere la torta? Si noti che, poiché i trade-off di allocazione delle risorse potrebbero avere una base genetica, e poiché genotipi diversi possono differire negli aspetti dell’allocazione delle risorse, la visione genetica e fisiologica dei trade-off non sono necessariamente incompatibili. Tuttavia, i trade-off fisiologici a livello individuale non sempre si traducono in trade-off genetici (evolutivi) a livello di popolazione. Per esempio, quando il trade-off fisiologico (intra-individuale) è geneticamente fissato (“hard-wired”) tra tutti gli individui all’interno della popolazione, tutti gli individui mostreranno la stessa relazione fisiologica negativa tra due tratti della storia della vita, ma la correlazione genetica tra gli individui sarà zero (Stearns 1989, Stearns 1992).
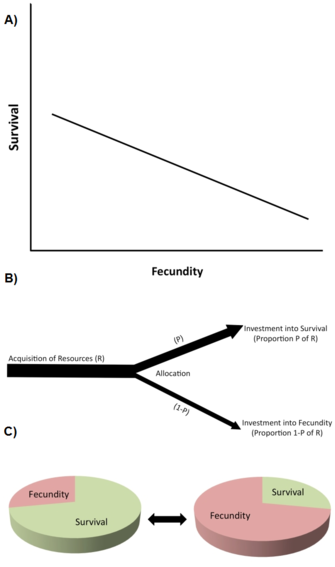
Il libro di Stearns (1992) elenca 45 possibili trade-off tra 10 tratti principali della storia della vita, e molti altri possono essere previsti. I trade-off che hanno ricevuto più attenzione includono (1) riproduzione attuale contro sopravvivenza; (2) riproduzione attuale contro riproduzione futura; (3) riproduzione attuale contro crescita dei genitori; (4) riproduzione attuale contro condizione dei genitori; e (5) numero contro dimensione della prole.
Alcune delle migliori prove dei trade-off genetici sulla storia della vita provengono dalla selezione artificiale e dagli esperimenti di evoluzione sperimentale condotti in Drosophila (vedi le revisioni in Stearns e Partridge 2001, Flatt e Schmidt 2009, Flatt 2011). In sintesi, molti esperimenti hanno trovato: una correlazione negativa tra la fecondità precoce e la durata della vita adulta; una correlazione positiva tra il tempo di sviluppo e la dimensione del corpo; una correlazione positiva tra il tempo di sviluppo o la dimensione del corpo con la fecondità precoce; e una correlazione negativa tra la fecondità precoce e tardiva.
Altri vincoli sulle storie di vita che impediscono alla selezione naturale di raggiungere un particolare optimum di fitness possono coinvolgere fattori biofisici, biochimici e strutturali, proprietà di sviluppo dell’organismo, contingenze filogenetiche e storiche, o semplicemente una mancanza di variazione genetica (Stearns 1992, Houle 2001).
Plasticità fenotipica nei tratti della storia di vita
La variazione genetica e i vincoli non sono gli unici fattori che influenzano l’espressione e l’evoluzione dei tratti della storia di vita. Un’altra questione importante è che la variazione della storia della vita è spesso fortemente influenzata dall’ambiente (ad esempio, temperatura, nutrizione, predatori), un fenomeno chiamato plasticità fenotipica, cioè la capacità di un singolo genotipo (o clone) di produrre fenotipi diversi in ambienti diversi (Stearns 1992, Roff 1997, Pigliucci 2001, DeWitt e Scheiner 2004). La plasticità di un genotipo specifico può essere concettualmente descritta da una funzione matematica chiamata norma di reazione, cioè una linea o curva che mette in relazione i fenotipi prodotti da questo genotipo con i cambiamenti nell’ambiente che sperimenta (Figura 3A).
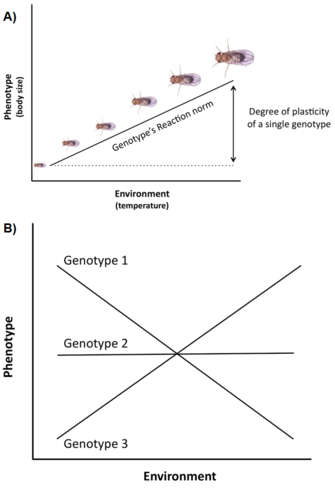
L’importanza di tale plasticità nell’evoluzione della storia della vita è almeno triplice (Stearns e Koella 1986, Stearns et al. 1991, Stearns 1992, Nylin e Gotthard 1998, DeWitt e Scheiner 2004, Flatt 2005): (1) poiché la plasticità modula l’espressione fenotipica della variazione genetica per singoli tratti della storia della vita e delle correlazioni genetiche per coppie di tratti, essa influenza la risposta genetica alla selezione negli ambienti; (2) se esiste una variazione adattativa tra i genotipi per la risposta plastica, la selezione può produrre una norma di reazione ottimale che massimizza la fitness negli ambienti; e (3) la plasticità di un tratto specifico può omeostaticamente tamponare l’organismo contro i cambiamenti indotti dall’ambiente in altri tratti in modo che la performance dell’organismo e quindi la fitness sia ottimizzata.
Molti tratti della storia della vita (ad es, età alla maturità, fecondità) mostrano un alto grado di plasticità, e c’è spesso una variazione genetica significativa per la plasticità nelle popolazioni naturali, cioè i genotipi hanno diverse norme di reazione, un fenomeno chiamato interazione genotipo-ambiente (GxE) (Figura 3B). Inoltre, non solo i singoli tratti ma anche le correlazioni tra i tratti possono essere plastiche, e diversi ambienti possono cambiare la pendenza e/o il segno della correlazione tra i tratti (Stearns et al. 1991, Stearns 1992). Nei rospi piedi di vanga (Scaphiophus couchii), per esempio, gli individui che si sviluppano in stagni di breve durata hanno un periodo larvale più breve e una dimensione corporea più piccola alla metamorfosi (i tratti sono correlati negativamente) rispetto agli individui che si sviluppano in stagni di lunga durata (i tratti sono correlati positivamente) (Newman 1988, Stearns et al. 1991).
Dopo aver discusso l’approccio di modellazione dell’ottimalità e i fattori che influenzano l’espressione dei tratti della storia della vita, passiamo ora a discutere alcune importanti previsioni per l’evoluzione delle storie di vita (per i dettagli vedi Stearns 1992, Roff 1992, Charlesworth 1994, Stearns 2000, Roff 2002).
Previsioni per l’evoluzione dei tratti della storia della vita
A quale età e dimensione dovrebbe maturare un organismo? Il successo riproduttivo di un genotipo dipende fortemente dal suo tasso di crescita e – come conseguenza della crescita – dalla sua età e dimensione alla maturità. Per prevedere l’età e le dimensioni ottimali alla maturità dobbiamo capire i costi e i benefici relativi (in termini di mortalità e riproduzione) di maturare presto o tardi e di crescere o rimanere piccoli. I benefici di una “strategia” sono i costi dell’altra, e viceversa. I benefici della maturazione precoce e di una taglia più piccola (cioè i costi della maturazione tardiva e di una taglia più grande) includono: (1) una maggiore probabilità di sopravvivenza fino alla maturità a causa di una più breve durata del rischioso periodo di sviluppo e giovanile, e (2) un tempo di generazione più breve che permette ai genitori di produrre prole che nasce prima e che inizia a riprodursi prima. Così, un’alta mortalità giovanile, per esempio, dovrebbe favorire l’evoluzione della maturità anticipata. Al contrario, i benefici di una maturazione più tardiva e ad una taglia più grande (cioè i costi di una maturazione più precoce e ad una taglia più piccola) includono: (1) una crescita più lunga che porta a dimensioni maggiori alla maturità e quindi a una maggiore fecondità (poiché la fecondità spesso aumenta con le dimensioni), (2) una minore mortalità degli adulti (e quindi potenzialmente una maggiore fecondità nel corso della vita) dovuta a dimensioni maggiori (la mortalità dovuta ai predatori è spesso inferiore per gli individui più grandi), e (3) una maggiore qualità della prole (ad esempio, un maggiore investimento per prole, migliori cure parentali) che migliora la sopravvivenza della prole prodotta.
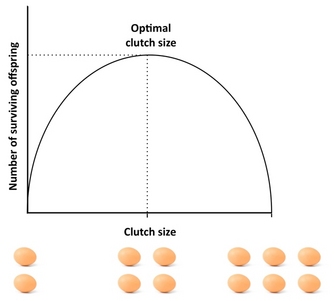
Quanta prole dovrebbe produrre un organismo? Un buon punto di partenza per affrontare questa domanda è la “frizione di Lack”, un concetto che risale all’ornitologo David Lack (1947). L’intuizione di base di Lack era che gli uccelli dovrebbero ottimizzare le dimensioni della loro frizione massimizzando il numero di prole (sopravvissuta). Le deviazioni da questa dimensione ottimale della frizione abbasserebbero il successo riproduttivo: se i genitori producono una frizione troppo grande, potrebbero non essere in grado di sostenere e allevare tutta la loro prole, con alcuni o tutti loro che muoiono, mentre se producono una frizione troppo piccola, il numero di figli nati potrebbe essere inferiore a quello che i genitori potrebbero sostenere (Figura 4). Anche se Lack era corretto nella sua affermazione che il fitness è spesso massimizzato a investimenti intermedi, le dimensioni della frizione sono tipicamente più piccole di quello che la frizione Lack predice. Questo perché il concetto ignora diversi fattori che possono ridurre le dimensioni della frizione, tra cui la mortalità dei genitori, la riproduzione futura, il tasso di produzione dei nipoti e il conflitto genitori-figlia. Per esempio, l’esistenza di compromessi tra la riproduzione attuale e la sopravvivenza dei genitori, la riproduzione attuale e futura, o il numero e la dimensione della prole può causare deviazioni dalla frizione Lack, e i modelli che prendono in considerazione tali fattori di solito producono un migliore adattamento con la dimensione della frizione osservata rispetto alla frizione Lack. Per un eccellente studio empirico della dimensione ottimale della frizione si veda lo studio di Daan et al. (1990) sui gheppi europei.
Quanto spesso dovrebbe riprodursi un organismo? Dovrebbe essere semelupo (cioè, riprodursi una sola volta) o iteroparo (cioè, riprodursi più volte) (Figura 5; vedi anche Young 2010)? La teoria suggerisce che l’iteroparità e l’evoluzione di una maggiore durata della vita riproduttiva sono favorite quando la sopravvivenza degli adulti è alta e quando la fecondità degli adulti o la sopravvivenza dei giovani è bassa: l’alta sopravvivenza degli adulti (o non variabile) aumenta il numero di eventi riproduttivi per tutta la vita, e la bassa (o variabile) fecondità o la sopravvivenza dei giovani causano perdite di fitness che selezionano un maggiore sforzo riproduttivo compensativo. Al contrario, la semelparità e l’evoluzione di una ridotta durata della vita riproduttiva sono favorite quando la sopravvivenza degli adulti è bassa e quella dei giovani è alta. Così, un’alta (o non variabile) sopravvivenza degli adulti rispetto a quella dei giovani favorisce l’iteroparità e allunga la durata della vita riproduttiva, mentre un’alta (o variabile) mortalità degli adulti rispetto a quella dei giovani favorisce la semelparità e accorcia la durata della vita riproduttiva. Gli organismi semelpari hanno tipicamente un maggiore sforzo riproduttivo rispetto agli organismi iteropari.

Le considerazioni di cui sopra sono aspetti di una questione più generale chiamata “problema generale della storia della vita” o “modello dello sforzo riproduttivo” (Schaffer 1983, Stearns 1992, Roff 1992, Charlesworth 1994): dato che la riproduzione ha sia benefici (es, produzione di prole) e costi (ad esempio, diminuzione della riproduzione futura, aumento della mortalità dei genitori o della prole), qual è l’investimento riproduttivo ottimale che massimizza il fitness? Molti studi teorici ed empirici hanno affrontato questo problema; alcune delle principali conclusioni di questo lavoro sono (vedi Stearns 1992, Roff 1992, Charlesworth 1994): (1) lo sforzo riproduttivo spesso, ma non sempre, aumenta con l’età perché ci si aspetta che il costo della riproduzione attuale in termini di riproduzione futura diminuisca con l’età (poiché il numero di eventi riproduttivi futuri in cui i costi possono manifestarsi diminuisce con l’età); (2) se lo sforzo riproduttivo produce rendimenti decrescenti o se la mortalità aumenta all’aumentare dello sforzo, sono favoriti gli investimenti riproduttivi intermedi e l’iteroparità; altrimenti, sono favoriti lo sforzo riproduttivo massimo e la semiparità; (3) se la mortalità aumenta in tutte le classi di età, lo sforzo riproduttivo aumenta all’inizio della vita e l’età alla maturità diminuisce; allo stesso modo, se la mortalità degli adulti aumenta, l’età alla maturità dovrebbe diminuire; e (4) se la mortalità aumenta dopo una particolare età (o in una specifica classe di età), lo sforzo riproduttivo aumenta prima e diminuisce dopo tale età. Come prove particolarmente belle di tali modelli di sforzo riproduttivo, rimandiamo il lettore agli esperimenti di campo e di laboratorio di David Reznick e colleghi sui guppy di Trinidad (ad esempio, Reznick et al. 1990).
Quanto tempo dovrebbe vivere un organismo (vedi anche Fabian e Flatt 2011)? L’evoluzione della durata della vita può essere vista come un equilibrio tra la selezione per una maggiore durata della vita riproduttiva (e quindi potenzialmente un maggiore successo riproduttivo) e l’invecchiamento (cioè l’aumento intrinseco della mortalità dipendente dall’età). I benefici dell’evoluzione di una maggiore durata della vita riproduttiva includono (vedi anche sopra): (1) un numero maggiore di eventi riproduttivi (e quindi di prole) per vita se la mortalità estrinseca degli adulti è bassa, (2) tempo sufficiente per compensare riproduttivamente la prole persa a causa dell’alta mortalità giovanile, e (3) una minore incertezza riproduttiva dovuta all’alta variazione della mortalità giovanile da un ciclo di riproduzione all’altro, sempre grazie alla possibilità di compensare la prole persa. Questi effetti sono contrastati da quelli che aumentano la mortalità degli adulti (ad esempio, i costi di sopravvivenza della riproduzione; l’invecchiamento) rispetto alla mortalità giovanile. Così, gli aumenti della media (e/o della varianza) della mortalità adulta rispetto a quella giovanile tendono a favorire una più breve durata della vita riproduttiva e la semelparità, mentre le diminuzioni della media (e/o della varianza) della mortalità adulta rispetto a quella giovanile tendono a favorire una più lunga durata della vita riproduttiva e l’iteroparità.
Oggi molte di queste previsioni della teoria della storia della vita sono ben supportate dall’evidenza; concluderemo questo articolo dando un esempio di un esperimento particolarmente elegante che ha confermato le principali previsioni del “problema generale della storia della vita”.
Un esempio di test empirico della teoria
Per testare i principi fondamentali della teoria della storia della vita, Stearns et al. (2000) hanno usato una popolazione di moscerini della frutta (D. melanogaster) per stabilire due serie di linee di “evoluzione sperimentale” replicate: tre linee sono state esposte a un trattamento di alta mortalità degli adulti (HAM; uccidendo a caso il 90% delle mosche due volte a settimana) e tre linee a un trattamento di bassa mortalità degli adulti (LAM; uccidendo il 10% delle mosche due volte a settimana). Dopo quattro anni di evoluzione sperimentale in queste condizioni in laboratorio, Stearns e collaboratori hanno misurato i fenotipi della storia della vita di tutte le linee in entrambi i trattamenti per esaminare le risposte evolutive delle mosche all’alta e alla bassa mortalità estrinseca. I risultati di questo esperimento a lungo termine sono stati sia chiari che intriganti, confermando le previsioni teoriche: i moscerini della frutta che si erano evoluti in condizioni HAM si sono sviluppati più rapidamente come larve, si sono eclissati prima e ad una dimensione più piccola come adulti, hanno avuto un picco di fecondità iniziale più alto e hanno mostrato una durata di vita più breve rispetto alle mosche LAM che hanno evoluto la serie opposta di adattamenti. In altre parole, le mosche che si sono evolute in un ambiente altamente pericoloso hanno risposto evolutivamente accelerando il loro sviluppo, diminuendo la loro età e le dimensioni alla maturità, deponendo più uova prima e vivendo più brevemente: si sono adattate ad alti livelli di mortalità casuale spostando il loro sforzo riproduttivo alle età precedenti e comprimendo la loro intera storia di vita in una durata di vita più breve. Quindi, come i risultati di Reznick et al. (1990) nei guppy, questi risultati confermano le principali previsioni della teoria della storia della vita, in particolare il ruolo principale della mortalità estrinseca degli adulti nel modellare l’evoluzione della crescita, della maturazione, della riproduzione e dell’invecchiamento.
Sommario
Qui abbiamo introdotto le basi della teoria della storia della vita. La teoria della storia della vita cerca di capire come la selezione naturale progetta gli organismi per raggiungere il successo riproduttivo, data la conoscenza di come i fattori selettivi nell’ambiente (cioè la mortalità estrinseca) e i fattori intrinseci all’organismo (cioè i trade-off, i vincoli) influenzano la sopravvivenza e la riproduzione. Usando una varietà di metodi teorici ed empirici, e in particolare applicando il pensiero dell’ottimalità, i teorici della storia della vita hanno derivato importanti previsioni sull’evoluzione dei principali tratti della storia della vita, tra cui l’età e la taglia alla maturità, il numero e la taglia della prole, lo sforzo riproduttivo specifico per età o taglia, la durata della vita riproduttiva e l’invecchiamento. Sulla base di queste previsioni, e testandole in esperimenti sul campo e in laboratorio, per esempio su mosche, pesci o uccelli, i biologi della storia della vita ci hanno fornito alcune risposte convincenti a domande fondamentali come: Quanto velocemente dovrebbe svilupparsi un organismo? A quale età e dimensione dovrebbe maturare? Quanti figli dovrebbe avere e quanto grandi dovrebbero essere? Dovrebbe riprodursi una o più volte? E quanto tempo dovrebbe vivere? Affrontando questi problemi, la teoria della storia della vita ha avuto un grande impatto sulla nostra comprensione dell’adattamento per selezione naturale, la questione più fondamentale in tutta la biologia evolutiva.