Tutti i sali e gli ioni che si dissolvono in acqua di mare contribuiscono alla sua salinità complessiva. La salinità dell’acqua di mare è solitamente espressa come grammi di sale per chilogrammo (1000 g) di acqua di mare. In media, circa 35 g di sale sono presenti in ogni 1 kg di acqua di mare, quindi diciamo che la salinità media dell’oceano è di 35 parti per mille (ppt). Si noti che 35 ppt è equivalente al 3,5% (parti per cento). Alcune fonti ora usano unità pratiche di salinità (PSU) per esprimere i valori di salinità, dove 1 PSU = 1 ppt. Le unità non sono incluse, quindi possiamo riferirci semplicemente a una salinità di 35.
Molte sostanze diverse sono dissolte nell’oceano, ma sei ioni comprendono circa il 99,4% di tutti gli ioni dissolti in acqua di mare. Questi sei ioni principali sono (Tabella 5.3.1):
Tabella 5.3.1 I sei ioni principali in acqua di mare
| g/kg in acqua di mare | % di ioni in peso | ||
|---|---|---|---|
| Cloruro Cl- | 19.35 | 55,07% | |
| Sodio Na+ | 10,76 | 30,6% | |
| Solfato SO42- | 2,71 | 7.72% | |
| Magnesio Mg2+ | 1.29 | 3.68% | |
| Calcio Ca2+ | 0.41 | 1.17% | |
| Potassio K+ | 0.39 | 1.1% | |
| 99,36% |

Cloruro e sodio, i componenti del sale da cucina (cloruro di sodio NaCl), costituiscono oltre l’85% degli ioni nell’oceano, motivo per cui l’acqua di mare ha un sapore salato (Figura 5.3.1). Oltre ai costituenti principali, ci sono numerosi costituenti minori: radionucleotidi, composti organici, metalli ecc. Questi costituenti minori si trovano in concentrazioni di ppm (parti per milione) o ppb (parti per miliardo), a differenza degli ioni maggiori che sono molto più abbondanti (ppt) (Tabella 5.3.2). Per mettere questo in prospettiva, 1 ppm = 1 mg/kg, o l’equivalente di 1 cucchiaino di zucchero sciolto in 14.000 lattine di soda. 1 ppb = 1 μg/kg, o l’equivalente di 1 cucchiaino di una sostanza sciolta in cinque piscine olimpioniche! Questi costituenti minori rappresentano numerose sostanze, ma insieme costituiscono meno dell’1% degli ioni presenti nell’acqua di mare. Alcuni di questi possono essere importanti come minerali e oligoelementi vitali per gli organismi viventi, ma non hanno un grande impatto sulla salinità complessiva. Ma date le vaste dimensioni degli oceani, anche i materiali che si trovano in abbondanza di tracce possono rappresentare riserve abbastanza grandi. Per esempio l’oro è un elemento in tracce nell’acqua di mare, che si trova in concentrazioni di parti per trilione, eppure se si potesse estrarre tutto l’oro in un solo km3 di acqua di mare, varrebbe circa 20 milioni di dollari!
Tabella 5.3.2 Concentrazioni di alcuni elementi minori in acqua di mare
| g/kg in acqua di mare | g/kg in acqua di mare | |||
|---|---|---|---|---|
| Carbonio | 0.028 | Ferro | 2 x 10-6 | |
| Nitrogeno | 0,0115 | Manganese | 2 x 10-7 | |
| Ossigeno | 0.006 | Rame | 1 x 10-7 | |
| Silicio | 0.002 | Mercurio | 3 x 10-8 | |
| Fosforo | 6 x 10-5 | Oro | 4 x 10-9 | |
| Uranio | 3.2 x 10-6 | Piombo | 5 x 10-10 | |
| Alluminio | 2 x 10-6 | Radon | 6 x 10-19 |
Perché i sei ioni principali dell’acqua di mare comprendono oltre il 99% della salinità totale, i cambiamenti nell’abbondanza dei costituenti minori hanno poco effetto sulla salinità totale. Inoltre, la regola delle proporzioni costanti afferma che anche se la salinità assoluta dell’acqua dell’oceano può differire in luoghi diversi, le proporzioni relative dei sei ioni principali all’interno di quell’acqua sono sempre costanti. Per esempio, indipendentemente dalla salinità totale di un campione di acqua marina, il 55% della salinità totale sarà dovuto al cloruro, il 30% al sodio, e così via. Poiché la proporzione di questi ioni principali non cambia, li chiamiamo ioni conservatori.
Viste queste proporzioni costanti, per calcolare la salinità totale si può semplicemente misurare la concentrazione di uno solo degli ioni principali e usare quel valore per calcolare il resto. Tradizionalmente il cloruro è stato lo ione misurato perché è il più abbondante, e quindi il più semplice da misurare con precisione. Moltiplicando la concentrazione di cloruro per 1,8 si ottiene la salinità totale. Per esempio, guardando la figura 5.3.1, 19,25 g/kg (ppt) di cloruro x 1,8 = 35 ppt. Oggi, per misurazioni rapide della salinità, si usa spesso la conducibilità elettrica piuttosto che determinare le concentrazioni di cloruro (vedi box sotto).
Ci sono diversi metodi disponibili per misurare la salinità dell’acqua. Le misurazioni più precise utilizzano l’analisi chimica diretta dell’acqua di mare in laboratorio, ma ci sono diversi modi per ottenere misure immediate della salinità sul campo. Per una rapida stima della salinità, si può usare un rifrattometro portatile (a destra).

Questo strumento misura il grado di flessione, o rifrazione, dei raggi di luce mentre attraversano un fluido. Maggiore è la quantità di sali disciolti nel campione, maggiore è il grado di rifrazione della luce. L’osservatore intrappola una goccia d’acqua sullo schermo blu e guarda attraverso l’oculare. La linea di divisione tra le sezioni blu e bianca della scala (riquadro) può essere usata per leggere la salinità.
Per misurazioni più accurate, la maggior parte degli oceanografi usa uno strumento che misura la conducibilità elettrica. Una corrente elettrica viene fatta passare tra due elettrodi immersi nell’acqua, e più alta è la salinità, più facilmente la corrente sarà condotta (gli ioni nell’acqua di mare conducono correnti elettriche). Le sonde di conducibilità sono spesso raggruppate in uno strumento chiamato CTD, che sta per Conducibilità, Temperatura e Profondità, che sono i parametri più comunemente misurati. I CTD moderni possono essere equipaggiati con una serie di sonde che misurano parametri come la luce, la torbidità (chiarezza dell’acqua), i gas disciolti ecc. I CTD possono essere strumenti di grandi dimensioni (sotto), ma sono ampiamente disponibili anche piccole sonde di salinità portatili.

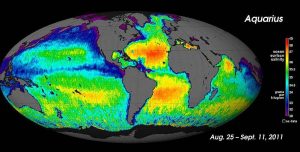
Per le misure di salinità su larga scala, gli oceanografi possono utilizzare i satelliti, come il satellite Aquarius, che è stato in grado di misurare le differenze di salinità superficiale come 0,2 PSU come ha mappato la superficie oceanica ogni sette giorni (sotto).
È importante essere consapevoli che mentre la regola delle proporzioni costanti si applica alla maggior parte dell’oceano, ci possono essere alcune aree costiere dove un sacco di scarichi fluviali possono alterare leggermente queste proporzioni. Inoltre, è importante ricordare che la regola delle proporzioni costanti si applica solo agli ioni maggiori. Le proporzioni degli ioni minori possono fluttuare, ma ricordate che danno un contributo molto minore alla salinità generale. Poiché le concentrazioni degli ioni minori non sono costanti, questi sono indicati come ioni non conservativi.
Perché gli ioni maggiori si trovano in proporzioni costanti? C’è un apporto costante di ioni dal deflusso dei fiumi e da altri processi, di solito in proporzioni molto diverse da quelle che si trovano nell’oceano. Allora perché le proporzioni negli oceani non cambiano? La maggior parte degli ioni scaricati dai fiumi hanno tempi di residenza abbastanza bassi (vedi sezione 5.2) rispetto agli ioni nell’acqua di mare, di solito perché sono utilizzati nei processi biologici. Questi bassi tempi di residenza non permettono agli ioni di accumularsi e alterare la salinità. Inoltre, il tempo di mescolamento dell’oceano mondiale è di circa 1000 anni, che è molto breve rispetto ai tempi di residenza degli ioni principali, che possono essere lunghi decine di milioni di anni. Quindi, durante il tempo di residenza di un singolo ione, l’oceano si è mescolato numerose volte, e gli ioni principali si sono distribuiti uniformemente in tutto l’oceano.
Variazioni nella salinità
La salinità totale nell’oceano aperto ha una media di 33-37 ppt, ma può variare significativamente in luoghi diversi. Ma poiché le proporzioni degli ioni principali sono costanti, le differenze regionali di salinità devono essere dovute più all’ingresso e alla rimozione di acqua che all’aggiunta o alla rimozione di ioni. L’ingresso di acqua dolce avviene attraverso processi come le precipitazioni, il deflusso dalla terra e lo scioglimento dei ghiacci. La rimozione dell’acqua dolce proviene principalmente dall’evaporazione e dal congelamento (quando l’acqua di mare si congela, il ghiaccio risultante è principalmente acqua dolce e i sali sono esclusi, rendendo l’acqua rimanente ancora più salata). Quindi le differenze nei tassi di precipitazione, evaporazione, scarico dei fiumi e formazione di ghiaccio giocano un ruolo significativo nelle variazioni regionali di salinità. Per esempio, il Mar Baltico ha una salinità superficiale molto bassa di circa 10 ppt, perché è un corpo d’acqua per lo più chiuso con molti apporti fluviali. Al contrario, il Mar Rosso è molto salato (circa 40 ppt), a causa della mancanza di precipitazioni e dell’ambiente caldo che porta ad alti livelli di evaporazione.
Uno dei grandi corpi d’acqua più salati della Terra è il Mar Morto, tra Israele e Giordania. La salinità del Mar Morto è di circa 330 ppt, cioè quasi dieci volte più salata dell’oceano. Questa salinità estremamente elevata è il risultato delle condizioni calde e aride del Medio Oriente, che portano ad alti tassi di evaporazione. Inoltre, negli anni ’50 il flusso del fiume Giordano è stato deviato dal Mar Morto, quindi non c’è più un significativo apporto di acqua dolce. Senza alcun apporto e con un’elevata evaporazione, il livello dell’acqua nel Mar Morto si sta ritirando al ritmo di circa 1 m all’anno. L’alta salinità rende l’acqua molto densa, il che crea forze di galleggiamento che permettono alle persone di galleggiare facilmente in superficie. Ma l’alta salinità significa anche che l’acqua è troppo salata per la maggior parte degli organismi viventi, quindi solo i microbi sono in grado di chiamarla casa; da qui il nome di Mar Morto. Ma per quanto salato possa essere il Mar Morto, non è il corpo d’acqua più salato della Terra. Questa distinzione appartiene attualmente a Gaet’ale Pond in Etiopia, con una salinità di 433 ppt!
Variazioni latitudinali
Mentre le condizioni locali sono importanti per determinare i modelli di salinità in ogni singola località, ci sono alcuni modelli globali che meritano ulteriori indagini. La temperatura è più alta all’equatore e più bassa vicino ai poli, quindi ci aspetteremmo tassi più alti di evaporazione, e quindi una salinità più alta, nelle regioni equatoriali (Figura 5.3.2). Questo è generalmente il caso, ma nella figura qui sotto la salinità proprio lungo l’equatore sembra essere un po’ più bassa che a latitudini leggermente più alte. Questo perché le regioni equatoriali ricevono anche un alto volume di pioggia su base regolare, che diluisce l’acqua superficiale lungo l’equatore. Così le salinità più alte si trovano alle latitudini subtropicali, calde, con alta evaporazione e meno precipitazioni. Ai poli c’è poca evaporazione, il che, insieme allo scioglimento del ghiaccio e della neve, produce una salinità superficiale relativamente bassa. L’immagine qui sotto mostra un’alta salinità nel Mar Mediterraneo; questo si trova in una regione calda con un’alta evaporazione, e il mare è in gran parte isolato dalla miscelazione con il resto dell’acqua del Nord Atlantico, portando ad un’alta salinità. Salinità più basse, come quelle intorno al sud-est asiatico, sono il risultato delle precipitazioni e degli alti volumi di apporto fluviale.

La figura 5.3.3 mostra le differenze medie globali tra evaporazione e precipitazione (evaporazione – precipitazione). I colori verdi rappresentano le aree in cui le precipitazioni superano l’evaporazione, mentre le regioni marroni sono quelle in cui l’evaporazione è maggiore delle precipitazioni. Si noti la correlazione tra precipitazioni, evaporazione e salinità superficiale come si vede nella figura 5.3.2.

Variazione verticale
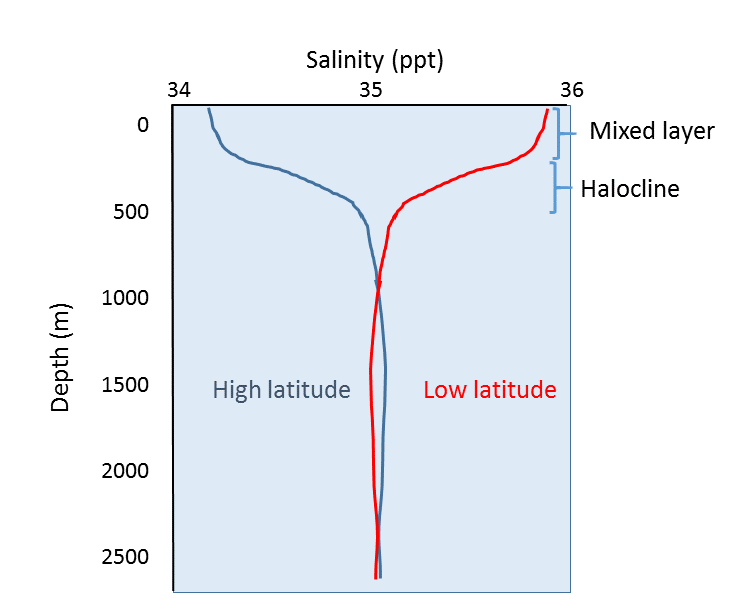
In aggiunta alla variazione geografica della salinità, ci sono anche variazioni di salinità con la profondità. Come abbiamo visto, la maggior parte delle differenze di salinità sono dovute a variazioni di evaporazione, precipitazioni, deflusso e copertura di ghiaccio. Tutti questi processi avvengono sulla superficie dell’oceano, non in profondità, quindi le differenze più pronunciate di salinità dovrebbero essere trovate nelle acque superficiali. La salinità nelle acque più profonde rimane relativamente uniforme, poiché non è influenzata da questi processi superficiali. Alcuni profili di salinità rappresentativi sono mostrati nella figura 5.3.4. In superficie, i primi 200 m circa mostrano una salinità relativamente uniforme in quello che è chiamato lo strato misto. I venti, le onde e le correnti superficiali agitano l’acqua superficiale, causando una grande quantità di miscelazione in questo strato e condizioni di salinità abbastanza uniformi. Sotto lo strato misto c’è una zona di rapido cambiamento di salinità su un piccolo cambiamento di profondità. Questa zona di rapido cambiamento è chiamata aloclino e rappresenta una transizione tra lo strato misto e l’oceano profondo. Al di sotto dell’aloclino, la salinità può mostrare poche variazioni fino al fondo del mare, poiché questa regione è molto lontana dai processi superficiali che influenzano la salinità. Nella figura qui sotto, si noti la bassa salinità superficiale alle alte latitudini, e la salinità superficiale più alta alle basse latitudini, come discusso sopra. Eppure, nonostante le differenze di superficie, la salinità in profondità in entrambe le località può essere molto simile.
un atomo o molecola che ha guadagnato o perso elettroni ed è quindi diventato carico (5.1)
la concentrazione di ioni disciolti in acqua (5.3)
una misura senza unità di misura della salinità pari a parti per mille (5.3)
i sei ioni che comprendono oltre il 99% degli ioni presenti nell’oceano (cloruro, sodio, solfato, magnesio, calcio, potassio) (5.3)
gli ioni principali nell’acqua di mare si trovano sempre nelle stesse proporzioni, indipendentemente dalla salinità complessiva (5.3)
gli ioni le cui proporzioni sono le stesse indipendentemente dalla salinità globale; gli ioni principali nell’acqua di mare (5.3)
gli ioni nell’acqua di mare le cui proporzioni fluttuano al variare della salinità (5.3)
flusso dell’acqua lungo un pendio, o attraverso la superficie del terreno, o all’interno di una serie di canali (12.2)
la quantità media di tempo che un elemento rimane nell’oceano prima di essere rimosso (5.2)
parti per mille
la distanza nord o sud dell’equatore, misurata come angolo dall’equatore (2.1)
lo strato più alto dell’oceano, dove i venti, le onde e le correnti mescolano l’acqua in modo che le condizioni siano relativamente costanti; approssimativamente i primi 100 m (5.3)
dove c’è un drammatico cambiamento di salinità per un piccolo cambiamento di profondità (5.3)