Crescita e proliferazione tumorale
In circostanze normali, mTOR è un importante regolatore della crescita e divisione cellulare. Tuttavia, nelle cellule tumorali, mTOR anormalmente attivato invia segnali che incoraggiano le cellule tumorali a crescere, metastatizzare e invadere nuovi tessuti sani. Tra questi, il percorso PI3K/fosfato e omologia dei funghi cancellati sul cromosoma 10 (PTEN)/AKT/TSC è il principale attivatore di mTORC1, e le mutazioni genetiche in questo percorso possono portare a tumori maligni. Inoltre, l’espressione di PTEN è spesso eliminata da modifiche epigenetiche, genetiche e post-trascrizionali per up-regolare il percorso PI3K/Akt/mTOR nella maggior parte dei tumori maligni.
Hou et al. hanno scoperto che le mutazioni nel gene PTEN hanno portato all’attivazione anomala del percorso PI3K/PTEN nel carcinoma a cellule epatiche (HCC). Inoltre, la delezione del gene PTEN induce l’espressione di B7-H1, che porta all’immunosoppressione e aumenta la progressione e l’invasione del tumore. Nel cancro del fegato, la via PI3K/PTEN/Akt/mTOR attivata è coinvolta nell’invasione tumorale e nelle metastasi mediante l’up-regolazione della metallopeptidasi 9 della matrice (MMP-9). Allo stesso modo, la via di segnalazione PI3K/Akt/mTOR è stata trovata per controllare la proliferazione e la sopravvivenza delle cellule staminali del cancro del colon (CCSC). Nel cancro sporadico del colon, le CCSC possono causare recidive e metastasi. Xie et al. hanno scoperto che la mutazione del gene liver kinase B1 (LKB1) o il segnale di crescita extracellulare potrebbero attivare mTORC1. MTORC1 inibisce l’attività della proteina ring finger protein 168 (RNF168) e promuove la sua degradazione fosforilando la 60° serina di RNF168. Questo ridurrà significativamente la modifica di ubiquitinazione dell’istone H2A e del membro X della famiglia di istoni H2A (H2AX) dopo il danno al DNA, che inibirà la risposta al danno al DNA e ridurrà la stabilità del genoma, portando alla promozione della trasformazione delle cellule maligne e del cancro. Inoltre, la ricerca esistente mostra che Rheb è una GTPasi che si lega e attiva mTORC1 quando il GTP viene caricato. Deng et al. hanno riferito che l’ubiquitinazione di Rheb è regolata dai segnali dei fattori di crescita. Rheb ubiquitinato inibisce l’attività di Rheb promuovendo il legame di Rheb a TSC2, portando all’inibizione dell’espressione di mTORC1. Oltre al percorso mTORC1, anche il percorso mTORC2 è coinvolto nella regolazione della comparsa e dello sviluppo delle cellule tumorali. Wang et al. hanno dimostrato che l’OTU deubiquitinasi 7B (OTUD7B) ha ridotto il livello di ubiquitinazione di GβL per evitare che GβL interagisca con SIN1, portando all’attivazione della via di segnalazione mTORC2/AKT e alla down-regolazione dell’espressione mTORC1. Questo attiva parzialmente la segnalazione oncogenica AKT e promuove la tumorigenesi. Tuttavia, l’ubiquitina ligasi TNF Receptor Associated Factor 2 (TRAF2) ha l’effetto opposto aumentando il livello di ubiquitinazione di GβL. Allo stesso modo, Kovalski et al. hanno dimostrato che le mutazioni di Ras possono legarsi a mTOR di mTORC2 e alla proteina 1 associata alla protein kinasi attivata da mitogeno (MAPKAP1) per promuovere l’attività della chinasi mTORC2, iniziando così programmi di trascrizione del ciclo cellulare proliferativo a valle.
In sintesi, mTOR è sempre stimolato nei tumori per mantenere la crescita, la sopravvivenza e la proliferazione delle cellule tumorali, e gioca un ruolo chiave nella biologia delle cellule tumorali (Fig. 1).
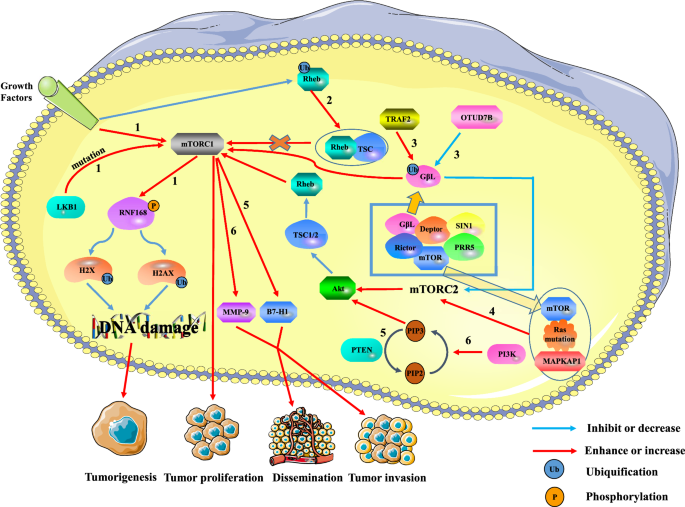
La relazione tra mTOR e tumori. L’iperattivazione di mTORC1 può promuovere la formazione del tumore, la proliferazione e le metastasi, mentre mTORC2 può regolare l’espressione di mTORC1 attraverso il percorso mTORC2/AKT/TSC/Rehb. Percorso 1: I segnali di crescita extracellulari e le mutazioni intracellulari di LKB1 attivano mTORC1, che riduce l’ubiquitinazione dell’istone H2A e H2A dopo un danno al DNA fosforilando RNF168. Questo può portare a danni alla riparazione del DNA e promuovere la formazione di tumori. Percorso 2: L’ubiquitinazione di Rheb riduce l’attività di Rheb promuovendo il legame di Rheb a TSC2. La down-regolazione di Rheb riduce l’attivazione di mTORC1, portando all’inibizione della crescita tumorale. Percorso 3: TRAF2 e Otud7B regolano rispettivamente l’attività di mTORC1/2 up-regolando o down-regolando il livello di ubiquitinazione di G beta L di mTORC2. TRAF2 ha aumentato l’attività di mTORC1 e inibito l’attività di mTORC2. Anche se la down-regolazione dell’espressione di mTORC2 inattiva la via AKT/TSC/Rehb/mTORC1, l’attività complessiva di mTORC1 è potenziata. Tuttavia, Otud7B ha l’effetto opposto su TRAF2. Percorso 4: Ras mutato lega mTOR e MAPKAP1 di mTORC2 per promuovere l’espressione di mTORC2. L’up-regolazione di mTORC2 promuove la proliferazione tumorale attraverso il percorso AKT/TSC/Rehb/mTORC1. Percorso 5: La delezione del gene PTEN induce l’espressione di B7-H1 per aumentare la progressione e l’invasione del tumore. Percorso 6: Il percorso PI3K/PTEN/AKT/mTOR è coinvolto nell’invasione e nella metastasi del cancro al fegato attraverso l’up-regolazione della MMP-9
Metabolismo del tumore
mTOR si attiva quando i nutrienti sono sufficienti, il che promuove l’anabolismo e lo stoccaggio e l’utilizzo di energia. Quando i nutrienti sono relativamente scarsi, il corpo deve inibire l’attivazione di mTOR per mantenere stabile il materiale cellulare e l’energia. Le cellule tumorali richiedono grandi quantità di proteine, lipidi e nucleotidi per rispondere ai loro bisogni di crescita e divisione. Pertanto, l’attività anormale della via mTOR si verifica spesso nei tumori, perché mTOR svolge un ruolo fondamentale nella regolazione del metabolismo.
Nelle cellule del cancro al seno, la via PI3K/AKT/mTORC1/sterol regulatory element-binding protein (SREBP) è il meccanismo principale per indurre la sintesi di nuovi lipidi e promuovere la proliferazione tumorale. La piruvato chinasi (PK) è coinvolta nel metabolismo degli zuccheri mentre la sintasi degli acidi grassi (FASN) è coinvolta nella sintesi degli acidi grassi (FA). Tao et al. hanno scoperto che la down-regolazione dell’espressione della piruvato chinasi M2 (PKM2) disattiva la via di segnalazione AKT/mTOR, riducendo così l’espressione di SREBP-1c. Il ridotto livello di espressione di SREBP-1c inibisce la generazione di FA inibendo la trascrizione del gene FASN, con conseguente crescita inibita delle cellule tumorali. Inoltre, Di Malta et al. hanno riferito che il gene up-regolato del fattore di trascrizione enhancer (TFE) può attivare la via Rag GTPase/mTORC1. Nelle cellule normali, questo percorso è attivato in modo che le cellule possano assorbire meglio i nutrienti per mantenere le funzioni fisiologiche. Nelle cellule tumorali, questo percorso è spesso iper-attivato per soddisfare le esigenze nutrizionali delle cellule tumorali in rapida crescita. Tuttavia, Guri et al. hanno esplorato che mTORC2 ha promosso la produzione di sfingomielina e cardiolipina in HCC. Da un lato, la sfingomielina e i fosfolipidi cardiaci sono entrambi componenti strutturali dei biofilm cellulari. D’altra parte, il metabolismo e il trasporto dei fosfolipidi cardiaci contribuiscono al corretto funzionamento dei mitocondri, quindi devono essere forniti in grandi quantità nelle cellule tumorali in rapida proliferazione. Questi risultati suggeriscono che la via di segnalazione mTORC2 promuove la proliferazione dell’HCC e la produzione di lipidi legati all’energia.
Come detto sopra, il metabolismo delle cellule tumorali può essere regolato dalla via mTOR per soddisfare le loro esigenze proliferative e nutrizionali. Al contrario, il metabolismo delle cellule tumorali può anche promuovere la crescita del tumore attraverso la via mTOR. Ericksen et al. hanno dimostrato che la riduzione della decomposizione degli aminoacidi a catena ramificata (BCAA) potrebbe promuovere la comparsa e lo sviluppo di tumori aumentando l’attività di mTORC1. Hanno anche concluso che l’attività dell’enzima chiave nel processo di catabolismo dei BCAA era altamente correlata all’invasione tumorale. Pertanto, l’accumulo di BCAA causato dall’inibizione del catabolismo dei BCAA nei tessuti tumorali del fegato può essere il meccanismo primario dell’attivazione cronica di mTORC1 del tumore. Allo stesso modo, Shi et al. hanno dimostrato che l’espressione del recettore dell’adenosina A2a (A2aR) nei tessuti del cancro gastrico (GC) era aumentato, e l’espressione di A2aR era correlata positivamente con lo stadio GC. I risultati suggeriscono che l’adenosina attiva la via di segnalazione PI3K/AKT/mTOR legandosi ad A2aR, che alla fine promuove il progresso del GC. Madak-Erdogan et al. hanno scoperto che gli acidi grassi liberi (FFA) hanno attivato le vie del recettore estrogenico α (ERα) e mTOR, che sono stati correlati con una maggiore proliferazione e invasività delle cellule di cancro al seno ER (+).
Questi studi indicano che la via di segnalazione mTOR è strettamente legata al metabolismo tumorale, e forniscono un supporto teorico per l’applicazione combinata di inibitori mTOR e alcuni farmaci che interferiscono con il metabolismo tumorale (Fig. 2).
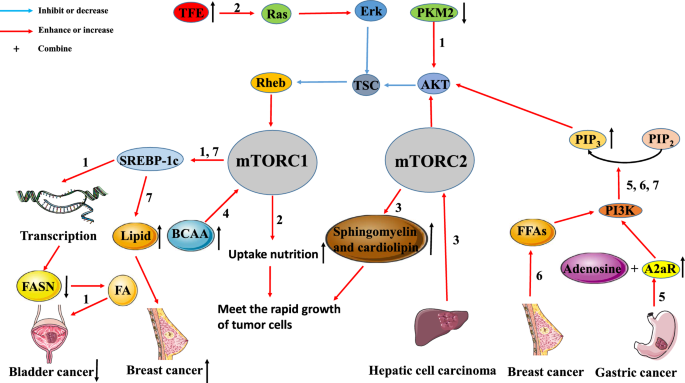
Interazione tra il metabolismo tumorale e la via di segnalazione mTOR. La via mTOR è strettamente legata al metabolismo tumorale. Percorso 1: Nel cancro della vescica, la down-regolazione dell’espressione di PKM2 riduce l’espressione di SREBP-1 attraverso il percorso AKT/TSC/Rehb/mTORC1 inattivato. La down-regolazione di SREBP-1c inibisce la generazione di FA inibendo la trascrizione di FASN, portando all’inibizione della crescita tumorale). Percorso 2: L’up-regolazione di TEF nei tumori attiva il percorso Ras/Erk/TSC/Rehb/mTORC1. L’attivazione di questo percorso promuoverà l’assorbimento di sostanze nutritive da parte delle cellule tumorali per soddisfare le esigenze della rapida crescita dei tumori. Percorso 3: L’HCC può aumentare la produzione di sfingomielina e cardiolipina attivando mTORC2. Grandi quantità di sfingomielina e cardiolipina sono usate per assemblare le membrane cellulari, che soddisfano anche i bisogni della rapida proliferazione tumorale. Percorso 4: L’accumulo di BCAA può promuovere la comparsa e lo sviluppo di tumori attivando mTORC1. Percorso 5: A2aR, che è altamente espresso nel cancro gastrico, lega l’adenosina per attivare il percorso PI3K/AKT/mTORC1. Percorso 6: Nel cancro al seno, FFAs promuove la proliferazione e la metastasi del tumore attivando il percorso PI3K/AKT/mTORC1. Percorso 7: Il percorso PI3K/AKT/mTORC1/SREBP promuove la proliferazione del cancro al seno inducendo la sintesi di nuovi lipidi
Cellule immunitarie
I tumori possono sviluppare tolleranza immunitaria sopprimendo la capacità del sistema immunitario di riconoscere e uccidere le cellule tumorali. L’immunoterapia dei tumori è un argomento di ricerca molto caldo negli ultimi anni, e una serie di prove dimostra che il percorso mTOR, che è spesso anormalmente attivato nei tumori, può regolare la differenziazione e la funzione delle cellule immunitarie.
Cellule T
Le cellule T-progenitrici dal midollo osseo entrano nel timo, dove si differenziano in due tipi di cellule: cellule T αβ e cellule T γδ. Attraverso l’esperimento di knockout genico, Yang et al. hanno dimostrato che la delezione di RAPTOR in mTORC1 interrompe il processo di rimodellamento del metabolismo ossidativo e del metabolismo del glucosio durante la differenziazione delle cellule T. Questo innesca la produzione di specie reattive dell’ossigeno (ROS), che interrompe la differenziazione delle cellule T αβ e aumenta la differenziazione delle cellule T γδ. Inoltre, Essig et al. hanno dimostrato che la roquin potrebbe down-regolare l’espressione del percorso PI3K/mTOR. La downregulation del percorso PI3K/mTOR non solo inibisce la differenziazione e l’attivazione delle cellule T tradizionali, ma limita anche la specializzazione delle cellule Treg. Pollizzi et al. hanno trovato in modelli di topo che l’attivazione di mTORC1 ha promosso la produzione di un cluster di differenziazione (CD) 8+ cellule T effettrici con alta glicolisi. Queste cellule T mantengono il fenotipo effettore ma non si convertono in un fenotipo di memoria. Al contrario, le cellule T con attività ridotta di mTORC1 hanno le caratteristiche delle cellule della memoria ma non possono differenziarsi in cellule effettrici, e non possono produrre una risposta di memoria immunitaria a causa della funzione metabolica difettosa. Ulteriori studi hanno mostrato che mTORC1 potrebbe influenzare la funzione effettrice delle cellule T CD8+, mentre l’attività mTORC2 regola la capacità di memoria delle cellule T CD8+.
In generale, la via di segnalazione mTOR può influenzare la differenziazione e la funzione delle cellule T. Questi studi estendono la nostra attuale comprensione della biologia delle cellule T.
Cellule natural killer e cellule dendritiche
La via di segnalazione mTOR non solo regola le cellule T, ma è strettamente legata alla differenziazione e alle funzioni delle cellule dendritiche (DC) e delle cellule natural killer (NK). Le DC hanno una forte capacità di presentazione dell’antigene e le cellule NK sono importanti cellule immunitarie nel corpo. Wang et al. hanno dimostrato che mTORC1 e mTORC2 regolano gli effetti delle cellule NK in un modo unico. Hanno scoperto che mTORC2 regola negativamente la funzione delle cellule NK principalmente inibendo l’asse trasduttore di segnale e attivatore della trascrizione 5 (STAT5)/famiglia di trasportatori soluti 7 membro 5 (SLC7A5). Mentre mTORC1 regola positivamente l’attività di mTORC2 mantenendo la via di segnalazione dell’interleuchina (IL)-15 mediata da CD122. Oltre alle cellule NK, negli ultimi anni si ritiene che anche il DC sia collegato alla via di segnalazione mTOR. Chen et al. hanno concluso che l’apoptosi delle DC derivate dalle cellule mononucleate del midollo osseo (BMM) era ridotta dopo il trattamento con gli inibitori mTOR. Hanno anche scoperto che le DC derivate dalle cellule BMM avevano migliori capacità di presentazione dell’antigene e che i linfociti T CD8+ citotossici e7-specifici attivati da queste DC avevano una maggiore attività antitumorale. Pertanto, gli inibitori mTOR possono aumentare l’efficacia dell’immunoterapia dei tumori estendendo la durata della vita delle DC, migliorando la presentazione dell’antigene e la capacità di elaborazione dell’antigene. Questi studi forniscono idee per il targeting delle cellule NK e DC per la terapia antitumorale.
Macrofagi
I macrofagi di tipo M1 possono uccidere le cellule tumorali in molteplici modi, mentre i macrofagi di tipo M2 promuovono la comparsa, l’invasione e le metastasi dei tumori. Zhihua et al. hanno riportato che l’espressione del microRNA (miRNA)-30c era significativamente ridotta nel GC. Ulteriori studi hanno dimostrato che l’hypoxia-inducible factor-1α (HIF-1α) ha inibito l’espressione del miRNA-30c. La downregulation del miRNA-30c ridurrà l’attività di mTOR e la glicolisi nei macrofagi legati al tumore. Questo finirà per promuovere la crescita e le metastasi del GC inibendo la differenziazione e la funzione dei macrofagi di tipo M1.
In generale, il percorso mTOR, che è spesso attivato nei tumori, promuove la crescita tumorale regolando la differenziazione e la funzione delle cellule immunitarie. Questo giocherà un ruolo positivo nell’esplorazione di nuove immunoterapie e nel miglioramento del trattamento dei tumori.
Resistenza ai farmaci del tumore
Targeting dei percorsi molecolari delle cellule tumorali è il modo in cui trattiamo vari tumori, ma i tumori inevitabilmente sviluppano resistenza ai farmaci. Una volta che il tumore diventa resistente, gli effetti collaterali del trattamento aumentano mentre l’efficacia del farmaco diminuisce significativamente.
I tumori dell’apparato digerente
Studi hanno dimostrato che la proteina 2 di disaccoppiamento mitocondriale (UCP2) porta alla resistenza tumorale a più farmaci anticancro riducendo i ROS generati dal metabolismo mitocondriale. Dando et al. hanno dimostrato che la combinazione di genipina ed everolimus potrebbe inibire sinergicamente la crescita delle cellule di adenocarcinoma pancreatico (PAAD) e indurre l’autofagia delle cellule tumorali. Questo perché l’inibizione di UCP2 nelle cellule PADD attiva la via Akt/mTOR attraverso un meccanismo dipendente dai ROS, che riduce l’effetto anti-proliferazione dell’inibitore UCP2 genipin. La via del riccio mediata dalla proteina zinc finger GLI1 gioca un ruolo importante nella GC. Tuttavia, Yao et al. hanno dimostrato che la via AKT/mTOR può attivare GLI1. Inoltre, le espressioni GLI1 e p-AKT erano correlate con le metastasi delle cellule tumorali e la resistenza ai farmaci, e il livello di espressione era correlato negativamente con la prognosi dei pazienti con GC.
Tumori respiratori
L’inibitore wee1 AZD1775, che mira alla riparazione del DNA e ai checkpoint del ciclo cellulare, ha dimostrato di essere efficace in alcuni pazienti con cancro ai polmoni, ma la resistenza ai farmaci è anche comune. A questo proposito, Sen et al. hanno scoperto che l’espressione della tirosin-chinasi del recettore AXL (ARK) nel carcinoma polmonare a piccole cellule (SCLC) resistente all’AZD1775 è stata up-regolata. ARK può direttamente o attraverso mTOR attivare la via delle protein chinasi regolate extracellulari (ERK) per reclutare e attivare la checkpoint kinase 1 (CHK1). Questi risultati suggeriscono che ARK può migliorare la riparazione dei danni al DNA attivando CHK1, che alla fine invalida l’inibitore Wee1. Allo stesso modo, Ye et al. hanno dimostrato che nel cancro del polmone non a piccole cellule (NSCLC), il membro della famiglia transmembrana-4 L-six-1 (TM4SF1) regola la sensibilità del tumore ai farmaci chemioterapici regolando l’espressione del recettore del dominio discoidale 1 (DDR1)/via Akt/ERK/mTOR.
Cancro del rene e cancro della pelle
Gli inibitori della tirosin-chinasi (TKI) possono essere usati per trattare il carcinoma a cellule renali (RCC), ma alcuni pazienti RCC sviluppano resistenza ai farmaci. Ishibashi et al. hanno riferito che il trattamento combinato dell’inibitore del recettore dell’interleuchina-6 (IL-6R) e dell’inibitore TKI a basse dosi era più efficace nell’inibire la crescita e l’angiogenesi del RCC in vivo rispetto all’uso del solo inibitore TKI. Questo perché le basse dosi di inibitori TKI inducono alti livelli di IL-6, che attiva il percorso AKT/mTOR. Questi risultati suggeriscono che il meccanismo del fallimento degli inibitori TKI in alcuni pazienti RCC è legato all’elevata attivazione di IL-6 della via di segnalazione mTOR.
Le mutazioni del proto-oncogene B-Raf (BRAF) si verificano nel cancro della pelle non melanoma (NMSC), ma gli inibitori BRAF non sono stati utilizzati in questi tumori. La ragione principale è che NMSC mutato in BRAF ha una resistenza primaria o secondaria agli inibitori BRAF. Sen et al. hanno trovato una forte correlazione tra la via di segnalazione PI3K/mTOR e la resistenza agli inibitori BRAF. Questo suggerisce che l’attivazione della via mTOR può portare alla resistenza di NMSC mutati BRAF agli inibitori BRAF. Inoltre, Obenauf et al. hanno scoperto che gli inibitori di BRAF, della tirosin-chinasi del recettore anaplastico (ALK) e del recettore del fattore di crescita epidermico (EGFR) hanno indotto alcuni segnali di secrezione nelle cellule tumorali, che hanno portato alla proliferazione e alla metastasi delle cellule tumorali resistenti ai farmaci. Ulteriori studi hanno scoperto che nelle cellule di melanoma trattate con l’inibitore BRAF, la downregulation del fattore di trascrizione FOS related antigen-1 (FRA1) attiva molteplici vie di segnalazione, tra cui la via PI3K/AKT/mTOR gioca un ruolo importante. Quando le vie di segnalazione BRAF e PI3K/AKT/mTOR sono inibite simultaneamente, la crescita delle cellule di melanoma umano BRAF mutate resistenti ai farmaci può essere inibita.
Gli studi di cui sopra suggeriscono che le cellule tumorali possono eludere la morte cellulare indotta dai farmaci antitumorali attivando la via di segnalazione intracellulare mTOR, quindi l’attivazione della via di segnalazione mTOR può essere uno dei meccanismi di resistenza ai farmaci nei tumori. Combinazioni di farmaci che hanno come bersaglio la via di segnalazione mTOR possono essere usate per trattare i tumori che hanno sviluppato resistenza.
Autofagia e apoptosi del cancro
Da un lato, l’autofagia può mantenere stabile il genoma rimuovendo gli organelli danneggiati e le proteine mal ripiegate, quindi può inibire la crescita delle cellule cancerose. D’altra parte, l’autofagia fornisce al tumore più sostanze nutritive, che rafforza la capacità del tumore di far fronte ad ambienti estremi. Inoltre, la proliferazione illimitata dei tumori è in parte dovuta all’inibizione dell’apoptosi delle cellule tumorali.
Sun et al. hanno concluso che mTOR inibisce l’espressione della glicogeno sintasi chinasi-3 (GSK-3) nelle cellule del cancro alla prostata. La down-regulation di GSK-3 inibisce la via di segnalazione della caspasi-3, portando alla riduzione della produzione di ROS. La diminuzione dei ROS inibisce l’apoptosi delle cellule tumorali per proteggere le cellule del cancro alla prostata. Tuttavia, Zou et al. hanno riferito che mTORC2 ha impedito all’inibitore canceroso della proteina fosfatasi 2A (CIP2A) di legarsi alla proteina fosfatasi 2A (PP2A) per ripristinare l’attività di PP2A. PP2A riduce la trascrizione di miR-9-3p e upregola l’espressione del fattore di trascrizione E2F 1 (E2F1) promuovendo la degradazione di c-Myc, quindi inibisce l’apoptosi delle cellule tumorali. Inoltre, Yang et al. hanno riferito che l’espressione di p-AKT, p-mTOR, P62 e B-cell lymphoma-2 (BCL-2) era significativamente diminuita nelle cellule di carcinoma a cellule squamose orali (OSCC) con knockdown dell’RNA lungo non codificante (lncRNA) CASC9, mentre l’espressione di BCL2 associated X (BAX) era aumentata. Questi risultati suggeriscono che l’lncRNA CASC9 inibisce l’apoptosi mediata dall’autofagia attraverso la via AKT/mTOR, che promuove la proliferazione delle cellule OSCC.
In sintesi, gli studi di cui sopra indicano che la via di segnalazione mTOR può promuovere la comparsa e la progressione dei tumori regolando l’autofagia e l’apoptosi delle cellule tumorali. Inoltre, la ricerca di cui sopra fornisce anche un supporto teorico per la ricerca clinica sui farmaci anticancro mirati, che è di grande importanza.