.jpg) La produzione di ammoniaca è fondamentale per l’industria agricola mondiale perché da essa vengono prodotti tutti i fertilizzanti che contengono azoto.
La produzione di ammoniaca è fondamentale per l’industria agricola mondiale perché da essa vengono prodotti tutti i fertilizzanti che contengono azoto.
Usi dell’ammoniaca
La produzione di fertilizzanti è di gran lunga l’uso più importante dell’ammoniaca. Questi includono urea, sali di ammonio (fosfati di ammonio, nitrato di ammonio, nitrato di ammonio di calcio) e soluzioni di ammoniaca.
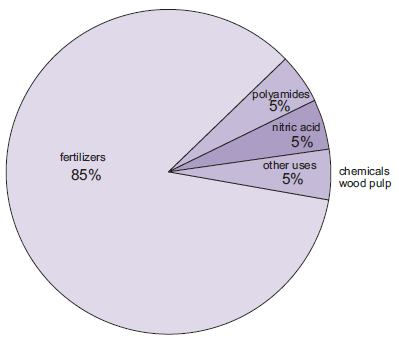
Figura 1 Gli usi dell’ammoniaca.
Una quantità crescente di ammoniaca, anche se ancora piccola rispetto agli altri usi, è usata come soluzione concentrata nella lotta contro lo scarico di ossidi di azoto dalle centrali elettriche.
Produzione annuale di ammoniaca
L’ammoniaca è al secondo posto, dopo l’acido solforico, come prodotto chimico con il maggior tonnellaggio. Viene sempre più prodotta in paesi che hanno fonti a basso costo di gas naturale e carbone (Cina e Russia rappresentano circa il 40%). Gli impianti più grandi producono circa 3000 tonnellate al giorno e ci sono piani per costruire impianti che producono 4000-5000 tonnellate al giorno, il che significa che la produzione mondiale totale potrebbe essere gestita con 100 unità di questo tipo. La produzione attuale è:
| Mondo | 146 milioni di tonnellate | |
| Cina | 48 milioni di tonnellate | |
| Russia | 12 milioni di tonnellate | |
| India | 11 milioni di tonnellate | |
| U.S. | 9 milioni di tonnellate | |
| Indonesia | 5 milioni di tonnellate | |
| Trinidad e Tobago | 5 milioni di tonnellate | |
| Ucraina | 4 milioni di tonnellate |
Dati da:
U.S. Geological Survey, Mineral Commodity Summaries, 2016.
L’aumento del tonnellaggio di ammoniaca prodotta è proprio al passo con la crescente polulazione mondiale e con il suo crescente standard di vita. Si prevede che la domanda di ammoniaca aumenterà a quasi 200 milioni di tonnellate entro il 20181.
1. International Fertilizer Association, 2014.
Fabbricazione dell’ammoniaca
La fabbricazione dell’ammoniaca da azoto e idrogeno avviene in due fasi principali:
a) la fabbricazione dell’idrogeno
b) la sintesi dell’ammoniaca (il processo Haber)
La fabbricazione dell’idrogeno comporta diversi processi distinti. La figura 2 mostra la loro sequenza e la posizione all’interno di un impianto di ammoniaca (fasi1-5). Viene anche mostrato il convertitore usato per fare ammoniaca dall’idrogeno (fase 6). Ciò che avviene in ciascuna di queste fasi è descritto sotto la figura.
|
Figura 2 Un impianto di ammoniaca in Australia occidentale: 1 Unità di desolforazione |
.jpg) |
(a) La produzione di idrogeno
L’idrogeno è prodotto da una varietà di materie prime, principalmente da gas naturale, carbone o nafta. I modi in cui l’idrogeno è ottenuto da queste materie prime sono trattati separatamente.
Idrogeno dal gas naturale (metano)
Questo comporta due fasi:
i) la produzione di gas di sintesi (una miscela di monossido di carbonio e idrogeno (steam reforming))
ii) la rimozione del monossido di carbonio e la produzione di una miscela di idrogeno e azoto (la reazione di shift)
(i) La produzione di gas di sintesi
In qualunque modo il metano sia ottenuto, conterrà alcuni composti organici dello zolfo e solfuro di idrogeno, che devono entrambi essere rimossi. Altrimenti, avveleneranno il catalizzatore necessario per la fabbricazione del gas di sintesi. Nell’unità di desolforazione, i composti organici dello zolfo sono spesso convertiti prima in solfuro di idrogeno, prima della reazione con l’ossido di zinco. La materia prima viene mescolata con idrogeno e passata su un catalizzatore di ossidi misti di cobalto e molibdeno su un supporto inerte (un’allumina appositamente trattata) a circa 700 K.
.jpg)
Poi i gas vengono passati su ossido di zinco a circa 700 K e l’idrogeno solforato viene rimosso:
.jpg)
Lo steam reforming primario converte metano e vapore in gas di sintesi, una miscela di monossido di carbonio e idrogeno:
.jpg)
Alte temperature e basse pressioni favoriscono la formazione dei prodotti (principio di Le Chatelier). In pratica, i reagenti sono passati su un catalizzatore di nichel, finemente suddiviso sulla superficie di un supporto di ossido di calcio/ossido di alluminio contenuto in tubi verticali in lega di nichel. I tubi, fino a 350 in parallelo, sono riscaldati in un forno sopra i 1000 K e sotto una pressione di circa 30 atm. Questo è un esempio di reattore tubolare.
Il reforming secondario del vapore fa reagire l’ossigeno dell’aria con parte dell’idrogeno presente e la miscela risultante viene passata su un catalizzatore di nichel. Il vapore e il calore prodotti dalla combustione riformano la maggior parte del metano residuo. Tra le reazioni chiave ci sono:
small.jpg)
Il gas emergente da questa fase esotermica netta è a circa 1200 K e viene raffreddato in scambiatori di calore. Il vapore formato dall’acqua usata nel raffreddamento dei gas è usato per far funzionare le turbine e quindi i compressori e per preriscaldare i reagenti.
Alcuni progetti recenti usano il calore di scarto del reformer secondario direttamente per fornire calore al reformer primario.
A questo stadio il gas contiene idrogeno, azoto, monossido di carbonio e anidride carbonica e circa lo 0,25% di metano. Poiché l’aria contiene l’1% di argon, anche questo si accumula nel gas di sintesi.
(ii) La reazione di spostamento
Questo processo converte il monossido di carbonio in anidride carbonica, generando più idrogeno.
Si svolge in due fasi. Nella prima, la reazione di spostamento ad alta temperatura, il gas è mescolato con vapore e passato su un catalizzatore di ossido di ferro/cromo (III) a circa 700 K in un reattore a letto fisso. Questo diminuisce la concentrazione di monossido di carbonio dall’11%:
.jpg)
Nel secondo stadio, la reazione di spostamento a bassa temperatura, la miscela di gas viene passata su un catalizzatore rame-zinco a circa 500 K. La concentrazione di monossido di carbonio viene ulteriormente ridotta allo 0,2%.
La reazione avviene in due fasi per diverse ragioni. La reazione è esotermica. Tuttavia, ad alta temperatura, la concentrazione in uscita di monossido di carbonio è ancora abbastanza alta, a causa del controllo dell’equilibrio. Il catalizzatore di rame usato nella fase a bassa temperatura è molto sensibile alle alte temperature, e non potrebbe funzionare efficacemente nella fase ad alta temperatura. Così, la maggior parte della reazione viene effettuata ad alta temperatura per recuperare la maggior parte del calore. Il gas viene poi rimosso a bassa temperatura, dove l’equilibrio è molto più favorevole, sul catalizzatore di rame molto attivo ma instabile.
La miscela di gas contiene ora circa il 18% di anidride carbonica che viene rimossa mediante scrubbing del gas con una soluzione di una base, utilizzando uno dei diversi metodi disponibili. Uno dei metodi preferiti è una base organica (nell’assorbitore di anidride carbonica), una soluzione di etanolamina, spesso 2,2′-(metilimino)bis-etanolo (N-metil dietanolamina).
L’anidride carbonica viene rilasciata riscaldando la soluzione nello stripper dell’anidride carbonica.) Gran parte di essa viene liquefatta e venduta, per esempio, per le bevande gassate, come refrigerante per le centrali nucleari e per promuovere la crescita delle piante nelle serre.
Le ultime tracce di ossidi di carbonio vengono eliminate facendo passare i gas su un catalizzatore di nichel a 600 K:
.jpg)
Questo processo è noto come metanazione. Si ottiene un gas di composizione tipica: 74% idrogeno, 25% azoto, 1% metano, insieme a un po’ di argon.
Idrogeno dalla nafta
Se la nafta è usata come materia prima, è necessaria una fase di reforming supplementare. La nafta viene riscaldata per formare un vapore, mescolato con vapore e fatto passare attraverso tubi, riscaldati a 750 K e imballati con un catalizzatore, nichel supportato su una miscela di ossidi di alluminio e magnesio. Il prodotto principale è il metano insieme agli ossidi di carbonio, e viene poi lavorato per steam reforming, come se fosse gas naturale, seguito dalla reazione di shift.
Idrogeno dal carbone
Se si usa il carbone, viene prima macinato finemente e riscaldato in un’atmosfera di ossigeno e vapore. Una parte del carbone brucia molto rapidamente nell’ossigeno (in meno di 0,1 s) facendo salire la temperatura nel forno e il resto del carbone reagisce con il vapore:
.jpg)
Il gas emesso contiene circa il 55% di monossido di carbonio, 30% di idrogeno, 10% di anidride carbonica e piccole quantità di metano e altri idrocarburi. Questa miscela è trattata dalla reazione di spostamento.
I principali problemi dell’uso del carbone includono le grandi quantità di anidride solforosa e triossido generati nella combustione del carbone e le quantità significative di altre impurità come l’arsenico e il bromo, tutte molto dannose per l’atmosfera e tutte molto velenose per i catalizzatori del processo. C’è anche un enorme problema di smaltimento delle ceneri.
Idrogeno dalla biomassa
Il gas di sintesi può essere prodotto dalla bio-massa. Il processo è descritto nell’unità sulle bioraffinerie.
(b) La produzione di ammoniaca (Il processo Haber)
.jpg)
Il cuore del processo è la reazione tra idrogeno e azoto in un reattore a letto fisso. I gas, in proporzioni stechiometriche, sono riscaldati e passati sotto pressione su un catalizzatore (Figura 3).
.jpg)
Figura 3 Un diagramma che illustra un reattore di sintesi convenzionale (un convertitore).
La proporzione di ammoniaca nella miscela di equilibrio aumenta all’aumentare della pressione e al diminuire della temperatura (principio di Le Chatelier). I dati quantitativi sono riportati nella tabella 1. Per ottenere una resa ragionevole e un tasso favorevole, si utilizzano pressioni elevate, temperature moderate e un catalizzatore.
| Pressione/atm | Percentuale di ammoniaca presente all’equilibrio in un intervallo di temperature | |||||
|---|---|---|---|---|---|---|
| 373 K | 473 K | 573 K | 673 K | 773 K | 973 K | |
| 10 | – | 50.7 | 14.7 | 3.9 | 1.2 | 0.2 |
| 25 | 91.7 | 63.6 | 27.4 | 8.7 | 2.9 | – |
| 50 | 94.5 | 74.0 | 39.5 | 15.3 | 5.6 | 1.1 |
| 100 | 96.7 | 81.7 | 52.5 | 25.2 | 10.6 | 2.2 |
| 200 | 98.4 | 89.0 | 66.7 | 38.8 | 18.3 | – |
| 400 | 99.4 | 94.6 | 79.7 | 55.4 | 31.9 | – |
| 1000 | – | 98.3 | 92.6 | 79.8 | 57.5 | 12.9 |
Tabella 1 Percentuale, in volume, di ammoniaca nella miscela di equilibrio per la reazione
tra azoto e idrogeno in una gamma di temperature e pressioni.
Si usa una vasta gamma di condizioni, a seconda della costruzione del reattore. Le temperature utilizzate variano tra 600 e 700 K, e le pressioni tra 100 e 200 atmosfere. Si sta lavorando molto per migliorare l’efficacia del catalizzatore in modo da poter utilizzare pressioni fino a 50 atmosfere.
Poiché la reazione è esotermica, vengono aggiunti reagenti freddi (azoto e idrogeno) per ridurre la temperatura dei reattori (Figura 3).
L’ammoniaca viene solitamente immagazzinata in loco (fase 7) e pompata in un’altra parte dell’impianto dove viene convertita in un fertilizzante (urea o un sale di ammonio). Tuttavia a volte viene trasportata via mare (Figura 4) o su strada, per essere utilizzata in un altro impianto.
.jpg) |
Figura 4 In un impianto in Australia Occidentale, l’ammoniaca viene trasferita tramite una conduttura ad un porto vicino (Figura 2, passo 8) e trasportata via nave. Questa trasporta circa 40 000 tonnellate di ammoniaca liquefatta. Per gentile concessione di Yara International ASA. |
Il catalizzatore originale che Haber usava era Fe3O4, che veniva ridotto dal reagente, l’idrogeno, a ferro. Molto lavoro è stato fatto per migliorare il catalizzatore e si è scoperto che una piccola quantità di idrossido di potassio era efficace come promotore.
Di recente la ricerca si è concentrata sulla ricerca di catalizzatori ancora più efficaci per permettere al processo di avvenire a pressioni e temperature più basse. Il rutenio su una superficie di grafite è un catalizzatore promettente.
.jpg)
Figura 5 La produzione di ammoniaca.
Postscript
Il processo Haber è di tale importanza per le nostre vite che è comparso in tre premi Nobel per la chimica, tutti a scienziati tedeschi, in un periodo di quasi 90 anni, un record notevole.
Il primo fu dato nel 1918, a Fritz Haber, il chimico che sviluppò il processo in laboratorio. Il secondo fu assegnato a Carl Bosch, la cui brillante abilità ingegneristica rese il processo praticabile su larga scala, ma che aspettò fino al 1931 per il suo premio.
Nel 2007, Gerhard Ertl ha ricevuto il premio per il suo lavoro sulla catalisi delle reazioni gassose sui solidi. Tra la vasta gamma di reazioni che ha studiato, ha ottenuto la prova dell’adsorbimento di molecole di azoto e molecole di idrogeno sulla superficie del ferro e che queste molecole adsorbite si dissociano in atomi. Questi atomi si uniscono poi per gradi per formare la molecola di ammoniaca. Bisogna ricordare che le condizioni usate in questi studi (a meno di 10-10 atm) sono molto diverse dalle condizioni usate nell’industria, circa 150 atm.
Sommario
L’intero processo di produzione di ammoniaca dal metano è riassunto nella figura 5. Se il carbone o la nafta sono la materia prima, sono necessari processi extra. La nafta viene convertita in metano e ossidi di carbonio prima di andare nel reformer primario e quindi alla reazione di shift. Anche il carbone viene convertito in idrogeno e ossidi di carbonio e questa miscela viene poi sottoposta alla reazione di shift.