Znajomość metabolizmu bilirubiny prowadzi do zrozumienia czynników prowadzących do zwiększonego ryzyka wystąpienia kernicterus (patrz obrazek poniżej). Bilirubina jest wytwarzana podczas katabolizmu składnika hemowego krwinek czerwonych (RBC). Zniszczenie krwinek czerwonych jest zwykle zwiększone w okresie noworodkowym; może być patologicznie podwyższone w obecności choroby hemolitycznej o podłożu immunologicznym lub nieimmunologicznym. Pierwszym enzymem w kaskadzie katabolicznej prowadzącej do powstania bilirubiny jest oksygenaza hemowa. Rozpoznaje się formę konstytutywną i formę indukowalną, które są indukowane przez fizjologiczne czynniki stresowe. Tworzenie bilirubiny, potencjalnie toksycznego związku nierozpuszczalnego w wodzie, z biliwerdyny, nietoksycznej substancji rozpuszczalnej w wodzie, zużywa energię.
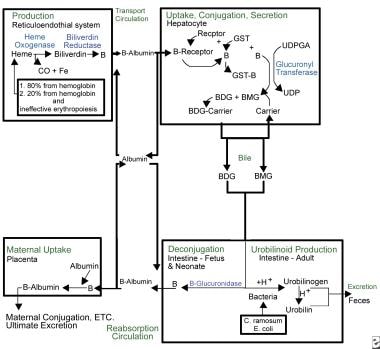 Kernicterus. Przegląd zagadnień związanych z metabolizmem bilirubiny.
Kernicterus. Przegląd zagadnień związanych z metabolizmem bilirubiny. Z powodu swojej lipofilnej natury, bilirubina musi być związana z albuminą, aby przemieszczać się w krwiobiegu. W tym stanie nie jest ona wolna, aby przekroczyć barierę krew-mózg i spowodować kernicterus. Kompleks albumina-bilirubina jest przenoszony do wątroby, gdzie bilirubina dostaje się do hepatocytu w celu dalszego metabolizmu. W wątrobie bilirubina jest sprzęgana poprzez działanie glukuronylotransferazy difosforanu urydyny (UDPGT), enzymu, który nie jest w pełni funkcjonalny do 3-4 miesiąca życia.
Sprzężona bilirubina jest wydalana do jelit przez układ żółciowy. Beta-glukuronidaza, obecna w świetle jelita u ludzkich noworodków, dekoniuguje sprzężoną bilirubinę, umożliwiając jej ponowne wchłonięcie przez błony komórek lipidowych jelita z powrotem do krwiobiegu, gdzie musi być ponownie związana z albuminą, aby powtórzyć cykl. Proces ten, zwany recyrkulacją enterohepatyczną, jest unikalnym zjawiskiem noworodkowym i w znacznym stopniu przyczynia się do żółtaczki fizjologicznej. Karmienie oraz wydalanie smółki i stolca przerywa recyrkulację enterohepatyczną.
Wśród niemowląt zgłoszonych do amerykańskiego rejestru kernicterus, 56% miało nieprawidłowości, o których wiadomo, że zwiększają stężenie bilirubiny we krwi. Ciężkie procesy hemolityczne rozpoznano u 25 ze 122 niemowląt (20,5%); niedobór dehydrogenazy glukozo-6-fosforanowej rozpoznano u 26 niemowląt (21,3%), uraz porodowy zidentyfikowano u 18 pacjentów (15%), a inne przyczyny, takie jak galaktozemia, zespół Criglera-Najjara i sepsa, rozpoznano u 8 niemowląt (7%). U 53 ze 122 niemowląt (43,4%) nie wykryto etiologii ciężkiej hiperbilirubinemii.
Zwiększona produkcja bilirubiny
Większość bilirubiny krążącej u noworodka powstaje w wyniku niszczenia krążących krwinek czerwonych. Noworodki produkują bilirubinę z ponad dwukrotnie większą szybkością niż przeciętny dorosły, głównie z powodu większej objętości krążących krwinek i krótszego czasu życia. Każde zdarzenie powodujące zwiększenie stężenia bilirubiny w surowicy krwi naraża noworodka na ryzyko wystąpienia hiperbilirubinemii.
Policytemia
Czynniki prenatalne, takie jak palenie tytoniu przez matkę, choroba matki, niewydolność łożyska i ciąża na dużej wysokości, mogą prowadzić do policytemii noworodków. Czynniki położnicze, takie jak opóźnione zaciśnięcie pępowiny, oderwanie pępowiny lub długotrwałe trzymanie dziecka poniżej poziomu introitów, mogą powodować zwiększenie masy RBC u dziecka. Dotyczy to w szczególności dzieci urodzonych bez przeszkolonego personelu medycznego.
Hemoliza
Immunologiczna choroba hemolityczna, najczęściej izoimmunizacja układu Rh (erythroblastosis fetalis), jest prototypową etiologią kernicterus.
IzoimmunizacjaABO, jak również mniejsze antygeny grup krwi, mogą również powodować chorobę hemolityczną u noworodka, zwykle o umiarkowanym nasileniu. Niemowlęta urodzone przez matki o grupie krwi O ujemnej są najbardziej zagrożone, a w jednej z serii 249 niemowląt z ciężką hiperbilirubinemią odnotowano iloraz szans 48,6 dla niemowląt z niezgodnością Rh.
Nieprawidłowości samej krwinki czerwonej mogą również predysponować do hemolizy. Można je pogrupować na defekty błonowe, takie jak dziedziczna sferocytoza i eliptocytoza; defekty enzymatyczne, takie jak niedobór dehydrogenazy glukozo-6-fosforanowej i niedobór kinazy pirogronianowej; oraz hemoglobinopatie, takie jak talasemie alfa i beta.
Choroba sierpowatokrwinkowa zazwyczaj nie powoduje choroby hemolitycznej w okresie noworodkowym.
Wysiększa ilość wynaczynionej krwi
Znaczne obszary zasinienia, takie jak ciężki cefalohematoma, krwotok podpaznokciowy lub wybroczyny obwodowe z urazu porodowego, mogą powodować zwiększony ładunek bilirubiny w surowicy w miarę ustępowania pobrania krwi. Wewnętrzne obszary krwotoku, takie jak krwawienia płucne lub wewnątrzkomorowe, mogą być również znaczącym ukrytym źródłem bilirubiny w surowicy.
Indukcja enzymów
Jak wspomniano powyżej, hemooksygenaza-on (HO-1) jest indukowalną formą pierwszego enzymu biorącego udział w tworzeniu bilirubiny. Enzym ten jest aktywowany przez fizjologiczne czynniki stresogenne, takie jak hipotermia, kwasica, hipoksja i infekcja (iloraz szans 20,6 w sepsie).
Czynniki epidemiologiczne
Niemowlęta z Azji Wschodniej i rdzennych Amerykanów produkują bilirubinę częściej niż niemowlęta rasy białej; niemowlęta rasy czarnej mają niższe wskaźniki produkcji niż niemowlęta z innych grup rasowych. Niemowlęta płci męskiej mają wyższy poziom bilirubiny w surowicy niż niemowlęta płci żeńskiej. Hiperbilirubinemia występuje również rodzinnie; etiologia jest niejasna, ale może być związana z genetycznie zwiększonym poziomem beta-glukuronidazy u niemowlęcia, w mleku matki lub w obu tych substancjach (jeśli niemowlę jest karmione piersią).
Zmniejszona eliminacja
Nawet w przypadku prawidłowej produkcji bilirubiny, nieprawidłowości w transporcie, wydalaniu lub obu tych procesach mogą powodować zwiększony poziom wolnej bilirubiny w surowicy.
Wiązanie albuminy
Z powodu swojej lipofilnej natury, bilirubina musi być związana z białkiem nośnikowym, aby mogła być transportowana w środowisku wodnym surowicy. Albumina ma jedno główne miejsce wiążące o wysokim powinowactwie do bilirubiny i dwa miejsca o niższym powinowactwie. Przy fizjologicznym pH, ilość wolnej bilirubiny (np. bilirubiny niezwiązanej z albuminą) jest bardzo niska. Jest to ważne, ponieważ tylko wolna bilirubina jest w stanie przekroczyć barierę krew-mózg i spowodować neurotoksyczność. Zmniejszona zdolność wiązania albuminy, zmniejszone powinowactwo wiązania albuminy lub oba te czynniki mogą przyczynić się do zwiększenia ilości wolnej bilirubiny w surowicy. Powinowactwo wiążące jest mniejsze u noworodków niż u starszych niemowląt i jest jeszcze mniejsze u wcześniaków i chorych niemowląt niż u zdrowych niemowląt.
Niektórzy autorzy opowiadają się za uwzględnieniem miar niezwiązanej (tj. wolnej) bilirubiny przy ocenie ryzyka neurotoksyczności bilirubiny, częściowo dlatego, że niektóre badania wykazały ściślejszy związek między stężeniem bilirubiny niezwiązanej a zaburzeniami słuchu niż te obserwowane w przypadku bilirubiny całkowitej w surowicy, chociaż identyfikacja progu neurotoksycznego stężenia bilirubiny niezwiązanej pozostaje nieuchwytna.
Zmniejszona zdolność wiązania może wystąpić w hipoalbuminemii lub jeśli miejsca wiązania są wypełnione innymi anionami. Kontrowersyjne jest, czy podany parenteralnie lipid może wyprzeć bilirubinę z miejsca wiążącego albuminy. W przypadku niebezpiecznie wysokiego stężenia bilirubiny w surowicy rozważne może być ograniczenie podawania lipidów do dawek mniejszych niż maksymalne. Leki, takie jak sulfizoksazol i ceftriakson, mogą również konkurować o miejsca wiążące bilirubinę w cząsteczce albuminy i muszą być stosowane ostrożnie lub należy ich unikać w okresie noworodkowym.
Wątrobowy wychwyt i koniugacja
Albumina przenosi bilirubinę do wątroby, gdzie jest ona włączana do hepatocytu przez białko akceptorowe zwane ligandynem. W wątrobie poziom ligandyny nie osiąga wartości dla dorosłych do około 5 dnia życia, ale może być indukowany przez podanie fenobarbitalu.
Po umieszczeniu w hepatocycie bilirubina jest sprzęgana z cząsteczką cukru, kwasem glukuronowym, przez enzym UDPGT. Wrodzony noworodkowy niedobór tego enzymu jest główną przyczyną żółtaczki fizjologicznej. Przez pierwsze 10 dni życia, UDPGT jest obecny na poziomie około 0,1% wartości dla dorosłych, a hiperbilirubinemia wydaje się być głównym bodźcem do produkcji enzymu.
Poza żółtaczką fizjologiczną, wrodzone defekty w UDPGT powodują patologiczną hiperbilirubinemię o różnym nasileniu. Zespół Criglera-Najjara typu I to wirtualny brak UDPGT i charakteryzuje się głęboką, oporną na leczenie hiperbilirubinemią z ciągłym ryzykiem wystąpienia kernicterus w dowolnym momencie życia jednostki. Obecnie jedyną ostateczną metodą leczenia jest przeszczepienie wątroby, choć prowadzone są badania nad terapiami eksperymentalnymi. Pacjenci z zespołem Criglera-Najjara typu II (tj. zespołem Ariasa) mają podobną prezentację kliniczną jak pacjenci z typem I. Jednakże pacjenci z typem II dramatycznie reagują na leczenie fenobarbitalem, co jest sposobem na postawienie diagnozy.
Zespół Gilberta charakteryzuje się łagodną przewlekłą pośrednią hiperbilirubinemią bez dowodów na chorobę lub nieprawidłowości wątroby. Genetyczne podłoże tego zespołu zostało zidentyfikowane jako amplifikowane powtórzenie tripletu w genie kodującym UDPGT, a badania są kontynuowane w celu wyjaśnienia możliwej roli zespołu Gilberta u niemowląt z noworodkową hiperbilirubinemią.
Wydalanie
Po sprzężeniu, rozpuszczalna w wodzie bilirubina jest wydalana w sposób zależny od energii do przewodów żółciowych w celu ostatecznego dostarczenia do jelita cienkiego. Zaburzenia w tym systemie lub niedrożność dróg żółciowych powodują nagromadzenie bilirubiny sprzężonej w surowicy, rozpoznawane przez podwyższenie bezpośredniej frakcji bilirubiny całkowitej. Bezpośrednia hiperbilirubinemia u noworodka (definiowana jako frakcja bezpośrednia większa niż jedna trzecia bilirubiny całkowitej) jest zawsze patologiczna i należy poszukiwać jej etiologii.
W jelicie cienkim bilirubina sprzężona nie może być ponownie wchłonięta. Flora jelitowa przekształca ją w urobilinogen, który jest wydalany. U noworodka niedostatek bakterii jelita grubego utrudnia tę konwersję. Ponadto, jelito noworodka (ale nie dorosłego) produkuje beta-glukuronidazę, enzym, który działa na sprzężoną bilirubinę, uwalniając wolną bilirubinę do potencjalnego wchłaniania przez błonę lipidową komórek jelita do krwiobiegu. Mleko matki również zawiera beta-glukuronidazę, a karmienie mlekiem matki zwiększa poziom tego enzymu w jelicie noworodka. W połączeniu z wolną motoryką jelit w pierwszych dniach życia, powyższe czynniki powodują tzw. enterohepatic recirculation of bilirubin back to the blood stream.
Faktory systemowe
Galaktozemia
Pacjenci z tym rzadkim wrodzonym błędem metabolizmu mogą występować przede wszystkim z hiperbilirubinemią, chociaż frakcja bezpośrednia zwykle wzrasta w drugim tygodniu życia. Dziecko może przejawiać inne charakterystyczne objawy, takie jak hepatomegalia, słabe karmienie lub senność. Badanie moczu na obecność substancji redukujących, ale nie glukozy, jest diagnostyczne. Wiele stanowych przesiewowych badań metabolicznych noworodków zawiera test na to zaburzenie.
Niedoczynność tarczycy
Ale etiologia jest niejasna, przedłużająca się pośrednia hiperbilirubinemia jest jedną z typowych cech wrodzonej niedoczynności tarczycy i to rozpoznanie musi być wykluczone u każdego dziecka z hiperbilirubinemią utrzymującą się po 2-3 tygodniu życia. Większość państwowych badań metabolicznych obejmuje oznaczenie czynności tarczycy, chociaż wyniki fałszywie ujemne i opóźnione otrzymanie wyników mogą wymagać indywidualnych badań u niemowląt z objawami.
Leki
Matczyne podawanie oksytocyny, diazepamu lub prometazyny może powodować zwiększenie stężenia bilirubiny w surowicy u niemowląt. Podobnie, noworodkowe podawanie pankuronium i wodzianu chloralu zwiększa stężenie bilirubiny. Dodatkowo, niektóre leki, takie jak sulfonamidy i niektóre penicyliny, mogą wypierać bilirubinę z jej miejsca wiązania z albuminami, skutecznie zwiększając stężenie wolnej bilirubiny w surowicy, dostępnej do przekroczenia bariery krew-mózg.
Kwasica
Kwasica systemowa zmniejsza powinowactwo albuminy do bilirubiny, co powoduje zwiększenie stężenia wolnej bilirubiny w krwiobiegu. Łatwa dostępność protonów sprzyja powstawaniu kwasu bilirubinowego (wolny anion bilirubiny plus 2 jony wodorowe); cząsteczka ta wykazuje zwiększone wiązanie i transport do błon komórek nerwowych.
Zaburzenia bariery krew-mózg
Bariera krew-mózg noworodka jest bardziej przepuszczalna dla substancji niż bariera dorosłego człowieka. Podawanie substancji hiperosmolarnych, hiperkarbia, asfiksja, infekcje (szczególnie zapalenie opon mózgowych) i upośledzona autoregulacja przy zmianach ciśnienia krwi mogą osłabić połączenia kapilarne, zwiększając przepuszczalność kapilar. To z kolei może obniżyć stężenie, przy którym bilirubina jest toksyczna dla OUN.
Karmienie mlekiem matki
Dobrze opisana żółtaczka fizjologiczna obserwowana w pierwszych dniach życia, szczególnie u niemowląt karmionych piersią, nazywana jest żółtaczką pokarmową. Uważa się, że żółtaczka związana z karmieniem piersią wynika z wielu opisanych powyżej mechanizmów, które promują produkcję i hamują wydalanie bilirubiny, jak również z niewystarczającego spożycia mleka z powodu zmniejszonej produkcji mleka przez gruczoły mleczne w pierwszych dniach po porodzie. Żółtaczkę związaną z karmieniem piersią należy odróżnić od żółtaczki wywołanej mlekiem matki.
Niektóre niemowlęta karmione piersią, mimo dobrej kondycji klinicznej, przez kilka miesięcy utrzymują hiperbilirubinemię pośrednią o nieustalonej etiologii. W przypadku zaobserwowania takiej sytuacji u niemowlęcia karmionego piersią można postawić diagnozę wykluczającą żółtaczkę z mleka matki. Uważa się, że taka hiperbilirubinemia jest spowodowana utrzymującym się wysokim poziomem jeszcze niezidentyfikowanych składników w mleku kobiecym, co skutkuje utrzymywaniem się hiperbilirubinemii u niemowlęcia. Pewną wskazówką może być historia podobnej hiperbilirubinemii u rodzeństwa karmionego piersią. Jednostka ta jest łagodna.