La familiarità con il metabolismo della bilirubina porta alla comprensione dei fattori che portano ad un aumentato rischio di kernicterus (vedi immagine sotto). La bilirubina è prodotta durante il catabolismo della componente eme dei globuli rossi (RBC). La distruzione dei globuli rossi è solitamente aumentata nell’immediato periodo neonatale; può essere patologicamente elevata in presenza di una malattia emolitica immunomediata o non immunomediata. Il primo enzima nella cascata catabolica che porta alla bilirubina è l’eme ossigenasi. Una forma costitutiva e una forma inducibile sono riconosciute e sono indotte da fattori di stress fisiologici. La creazione di bilirubina, un composto idrosolubile potenzialmente tossico, dalla biliverdina, una sostanza idrosolubile non tossica, consuma energia.
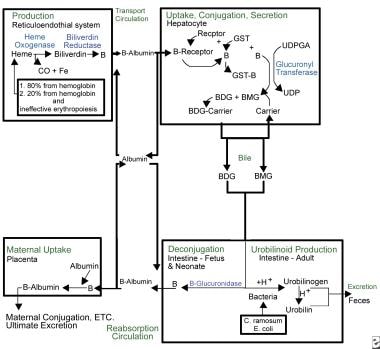 Kernicterus. Panoramica del metabolismo della bilirubina.
Kernicterus. Panoramica del metabolismo della bilirubina. A causa della sua natura lipofila, la bilirubina deve essere legata all’albumina per viaggiare nel flusso sanguigno. In questo stato, non è libera di attraversare la barriera emato-encefalica e causare il kernicterus. Il complesso albumina-bilirubina viene trasportato al fegato, dove la bilirubina entra nell’epatocita per un ulteriore metabolismo. Una volta nel fegato, la bilirubina viene coniugata attraverso l’azione dell’uridina difosfato glucuronil transferasi (UDPGT), un enzima non completamente funzionale fino a 3-4 mesi di vita.
La bilirubina coniugata viene escreta nel tratto intestinale attraverso il sistema biliare. La beta-glucuronidasi, presente nel lume intestinale dei neonati umani, deconiuga la bilirubina coniugata, permettendole di essere riassorbita attraverso le membrane cellulari lipidiche intestinali per tornare nel flusso sanguigno dove deve essere nuovamente legata all’albumina per ripetere il ciclo. Questo processo, chiamato ricircolo enteroepatico, è un fenomeno neonatale unico e contribuisce significativamente all’ittero fisiologico. L’alimentazione e l’escrezione del meconio e delle feci interrompono il ricircolo enteroepatico.
Tra i neonati segnalati nel registro americano del kernicterus, il 56% aveva anomalie note per aumentare la concentrazione di bilirubina nel sangue. I processi emolitici gravi sono stati identificati in 25 dei 122 bambini (20,5%); il deficit di glucosio-6-fosfato deidrogenasi è stato diagnosticato in 26 bambini (21,3%), il trauma alla nascita è stato identificato in 18 pazienti (15%), e altre cause come la galattosemia, la sindrome di Crigler-Najjar e la sepsi sono state diagnosticate in 8 bambini (7%). In 53 dei 122 neonati (43,4%), non è stata scoperta alcuna eziologia per la grave iperbilirubinemia.
Aumentata produzione di bilirubina
La maggior parte della bilirubina circolante nel neonato deriva dalla distruzione dei RBC circolanti. I neonati producono bilirubina a più del doppio del tasso giornaliero dell’adulto medio, principalmente a causa del maggior volume di RBC circolanti e della loro durata di vita più breve. Qualunque evento che comporti un aumento del carico di bilirubina nel siero mette il neonato a rischio di iperbilirubinemia.
Policitemia
Fattori prenatali, come fumo materno, malattia materna, insufficienza placentare e gestazione ad alta quota, possono provocare policitemia neonatale. Fattori ostetrici, come il ritardato clampaggio del cordone, lo stripping del cordone o il tenere il bambino sotto il livello dell’introito per un periodo prolungato, possono provocare un aumento della massa di RBC nel bambino. Questo è particolarmente vero per i bambini nati in assenza di un’assistente alla nascita addestrata.
Emolisi
La malattia emolitica immunitaria, più spesso isoimmunizzazione Rh (eritroblastosi fetale), è il prototipo di eziologia del kernicterus.
L’isoimmunizzazione ABO, così come gli antigeni minori del gruppo sanguigno, possono anche causare la malattia emolitica nel neonato, di solito di gravità moderata. I neonati nati da madri di gruppo sanguigno O negativo sono a maggior rischio, con una serie di 249 neonati con iperbilirubinemia grave che riporta un odds ratio di 48,6 per i neonati con incompatibilità Rh.
Anomalie del globulo rosso stesso possono anche predisporre all’emolisi. Queste possono essere raggruppate in difetti di membrana, come la sferocitosi ereditaria e l’elliptocitosi; difetti enzimatici, come il deficit di glucosio-6-fosfato deidrogenasi e il deficit di piruvato chinasi; ed emoglobinopatie, come le talassemie alfa e beta.
La malattia delle cellule malate non causa in genere malattie emolitiche nel periodo neonatale.
Sangue stravasato
Aree significative di ecchimosi, come un grave cefaloematoma, un’emorragia subgalea o ecchimosi periferiche da trauma alla nascita, possono provocare un aumento del carico di bilirubina nel siero quando la raccolta di sangue si risolve. Le aree interne di emorragia, come le emorragie polmonari o intraventricolari, possono anche essere una fonte occulta significativa di bilirubina nel siero.
Induzione dell’enzima
Come già detto, l’eme-ossigenasi-one (HO-1) è la forma inducibile del primo enzima coinvolto nella creazione della bilirubina. Questo enzima è attivato da fattori di stress fisiologici, come l’ipotermia, l’acidosi, l’ipossia e le infezioni (odds ratio 20,6 nella sepsi).
Fattori epidemiologici
I bambini asiatici e nativi americani producono bilirubina a tassi più elevati rispetto ai bambini bianchi; i bambini neri hanno tassi di produzione inferiori rispetto ai bambini di altri gruppi razziali. I neonati maschi hanno livelli di bilirubina nel siero più alti rispetto alle femmine. L’iperbilirubinemia corre anche nelle famiglie; l’eziologia non è chiara, ma può essere legata a livelli geneticamente aumentati di beta-glucuronidasi nel bambino, nel latte materno della madre o in entrambi (se il bambino è allattato al seno).
Riduzione dell’eliminazione
Anche in caso di produzione normale di bilirubina, anomalie nel trasporto, nell’escrezione o in entrambi possono provocare un aumento del livello di bilirubina libera nel siero.
Legame dell’albumina
A causa della sua natura lipofila, la bilirubina deve essere legata a una proteina carrier per essere trasportata nell’ambiente acquoso del siero. L’albumina ha un sito primario di legame ad alta affinità per la bilirubina e due siti a bassa affinità. A pH fisiologico, la quantità di bilirubina libera (per esempio, la bilirubina non legata all’albumina) è molto bassa. Questo è importante perché solo la bilirubina libera è disponibile per attraversare la barriera emato-encefalica e causare neurotossicità. Una diminuita capacità di legare l’albumina, una diminuita affinità di legame all’albumina o entrambe possono servire ad aumentare la quantità di bilirubina libera nel siero. L’affinità di legame è più bassa nei neonati che nei bambini più grandi ed è ancora più bassa nei neonati prematuri e malati che in quelli sani a termine.
Alcuni autori raccomandano di includere misure di bilirubina non legata (cioè libera) nella valutazione del rischio di neurotossicità da bilirubina, in parte perché alcuni studi hanno mostrato un’associazione più stretta tra la concentrazione di bilirubina non legata e le anomalie uditive rispetto a quelle osservate con la bilirubina sierica totale, anche se l’identificazione della soglia di concentrazione di bilirubina non legata neurotossica rimane sfuggente.
La ridotta capacità di legame può verificarsi in ipoalbuminemia o se i siti di legame sono riempiti con altri anioni. È controverso se un lipide somministrato per via parenterale possa spostare la bilirubina dal suo sito di legame con l’albumina. Se ci si trova di fronte a livelli pericolosamente alti di bilirubina nel siero, può essere prudente limitare la somministrazione di lipidi a livelli inferiori a quelli massimi. I farmaci, come il sulfisoxazolo e il ceftriaxone, possono anche competere per i siti di legame della bilirubina sulla molecola dell’albumina e devono essere usati con cautela o evitati nel periodo neonatale.
Assorbimento epatico e coniugazione
L’albumina porta la bilirubina al fegato, dove viene incorporata nell’epatocita da una proteina accettante chiamata ligandina. I livelli epatici di ligandina non raggiungono i valori dell’adulto fino a circa 5 giorni di età, ma possono essere indotti dalla somministrazione di fenobarbital.
Una volta all’interno dell’epatocita, la bilirubina viene coniugata a una parte di zucchero, l’acido glucuronico, attraverso l’enzima UDPGT. La carenza neonatale intrinseca di questo enzima è la principale eziologia dell’ittero fisiologico. Per i primi 10 giorni di vita, UDPGT è presente a livelli di circa lo 0,1% dei valori dell’adulto, e l’iperbilirubinemia sembra essere lo stimolo principale alla produzione dell’enzima.
Oltre all’ittero fisiologico, i difetti congeniti ereditati in UDPGT causano iperbilirubinemia patologica di varia gravità. La sindrome di Crigler-Najjar di tipo I è l’assenza virtuale di UDPGT ed è caratterizzata da una profonda iperbilirubinemia refrattaria con il rischio continuo di kernicterus in qualsiasi momento della vita di un individuo. Attualmente, il trapianto di fegato è l’unica terapia definitiva, anche se le terapie sperimentali sono in fase di studio. I pazienti con la sindrome di Crigler-Najjar di tipo II (cioè la sindrome di Arias) hanno una presentazione clinica simile a quella dei pazienti con il tipo I. Tuttavia, i pazienti con il tipo II rispondono drammaticamente alla terapia con fenobarbital, che è il modo in cui viene fatta la diagnosi.
La sindrome di Gilbert è caratterizzata da una benigna iperbilirubinemia cronica indiretta senza evidenza di malattia o anomalia epatica. La base genetica di questa sindrome è stata identificata come una tripla ripetizione amplificata nel gene codificante per UDPGT, e le indagini continuano per chiarire il possibile ruolo della sindrome di Gilbert nei neonati con iperbilirubinemia neonatale.
Escrezione
Una volta coniugata, la bilirubina idrosolubile viene escreta in modo dipendente dall’energia nei canalicoli biliari per essere consegnata nell’intestino tenue. L’interruzione di questo sistema o l’ostruzione del sistema biliare provoca un accumulo di bilirubina coniugata nel siero, identificato da un aumento della frazione diretta della bilirubina totale. L’iperbilirubinemia diretta nel neonato (definita come una frazione diretta maggiore di un terzo della bilirubina totale) è sempre patologica, e un’eziologia deve essere ricercata.
Nell’intestino tenue, la bilirubina coniugata non può essere riassorbita. La flora intestinale la converte in urobilinogeno, che viene escreto. Nel neonato, la scarsità di batteri del colon impedisce questa conversione. Inoltre, l’intestino neonatale (ma non quello dell’adulto) produce la beta-glucuronidasi, un enzima che agisce sulla bilirubina coniugata, rilasciando bilirubina libera per il potenziale assorbimento attraverso la membrana lipidica delle cellule intestinali nel flusso sanguigno. Il latte materno contiene anche la beta-glucuronidasi, e l’alimentazione con latte materno aumenta il livello di questo enzima nell’intestino neonatale. In combinazione con la lenta motilità intestinale nei primi giorni di vita, i fattori di cui sopra portano a quello che viene chiamato ricircolo enteroepatico della bilirubina nel flusso sanguigno.
Fattori sistemici
Galattosemia
I pazienti con questo raro errore congenito del metabolismo possono presentare principalmente un’iperbilirubinemia, anche se la frazione diretta aumenta tipicamente durante la seconda settimana di vita. Il bambino può manifestare altri segni caratteristici, come epatomegalia, scarsa alimentazione o letargia. L’urina per le sostanze riducenti, ma non il glucosio, è diagnostica. Molti schermi metabolici neonatali includono un test per questo disturbo.
Ipotiroidismo
Anche se l’eziologia non è chiara, l’iperbilirubinemia indiretta prolungata è una delle caratteristiche tipiche dell’ipotiroidismo congenito, e questa diagnosi deve essere esclusa in qualsiasi bambino con iperbilirubinemia persistente dopo 2-3 settimane di età. La maggior parte degli schermi metabolici statali includono un test della funzione tiroidea, anche se i risultati falsi negativi e la ricezione ritardata dei risultati possono rendere necessario un test individuale nei neonati sintomatici.
Farmaci
La somministrazione materna di ossitocina, diazepam o prometazina può determinare un aumento della bilirubina nel siero del neonato. Allo stesso modo, la somministrazione neonatale di pancuronio e idrato di cloralio aumenta i livelli di bilirubina. Inoltre, alcuni farmaci, come i sulfamidici e alcune penicilline, possono spostare la bilirubina dal suo sito di legame con l’albumina, aumentando effettivamente la concentrazione sierica di bilirubina libera disponibile per attraversare la barriera emato-encefalica.
Acidosi
L’acidosi sistemica diminuisce l’affinità di legame dell’albumina per la bilirubina, con conseguente aumento dei livelli di bilirubina libera nel sangue. La pronta disponibilità di protoni promuove la formazione dell’acido bilirubinico (anione bilirubina libera più 2 ioni idrogeno); questa frazione dimostra un aumento del legame e del trasporto nelle membrane delle cellule neurali.
Barriera emato-encefalica interrotta
La barriera emato-encefalica neonatale è più permeabile alle sostanze di quella dell’adulto. La somministrazione di sostanze iperosmolari, l’ipercarbia, l’asfissia, le infezioni (in particolare la meningite) e l’alterazione dell’autoregolazione con le variazioni della pressione sanguigna possono indebolire le giunzioni strette dei capillari, aumentandone la permeabilità. Questo, a sua volta, potrebbe abbassare la concentrazione alla quale la bilirubina è tossica per il SNC.
Alimentazione con latte materno
L’ittero fisiologico ben descritto osservato nei primi giorni di vita, in particolare nel bambino allattato al seno, è chiamato ittero da allattamento. Si pensa che l’ittero da allattamento derivi da meccanismi multipli, descritti sopra, che promuovono la produzione e inibiscono l’escrezione della bilirubina, così come dall’insufficiente assunzione di latte a causa della ridotta produzione di latte delle ghiandole mammarie nei primi giorni dopo il parto. L’ittero da allattamento deve essere distinto dall’ittero da latte materno.
Alcuni bambini allattati al seno, anche se clinicamente prosperi, continuano a manifestare un’iperbilirubinemia indiretta di eziologia non identificabile per diversi mesi. Se questo è testimoniato in un neonato allattato al seno, la diagnosi di esclusione di ittero da latte materno può essere fatta. Si pensa che tale iperbilirubinemia sia causata da livelli persistentemente alti di componenti non ancora identificati nel latte materno di alcune donne, che risultano nella persistenza dell’iperbilirubinemia del bambino. Un indizio può essere una storia di iperbilirubinemia simile in altri fratelli allattati al seno. Questa entità è benigna.