
Definicja
Gdy dwa różne metale lub stopy są zanurzone w roztworze korozyjnym lub regularnie łączone przez wilgoć, każdy z nich rozwinie potencjał korozji. Jeśli występują warunki do korozji galwanicznej, bardziej szlachetny metal stanie się katodą, a bardziej aktywny metal stanie się anodą. Pomiędzy anodą i katodą może płynąć mierzalny prąd. Jeśli to nastąpi, szybkość korozji anody w środowisku roboczym wzrośnie, podczas gdy szybkość korozji katody zmaleje. Zwiększona korozja anody nazywana jest „korozją galwaniczną.”
Korozja galwaniczna jest czasami wykorzystywana do przedłużenia żywotności materiałów (np. powłok cynkowych na stali węglowej i anod cynkowych w podgrzewaczach wody), ale jeśli nie jest brana pod uwagę i istnieją odpowiednie warunki, może prowadzić do nieoczekiwanych awarii.
Wymagania dotyczące korozji galwanicznej:
Aby wystąpiła korozja galwaniczna, wymagane są trzy elementy.
- Dwa metale o różnych potencjałach korozyjnych
- Bezpośredni kontakt elektryczny metal-metal
- Przewodzący roztwór elektrolitu (np. woda) musi regularnie łączyć oba metale. Roztwór elektrolitu tworzy „ścieżkę przewodzącą”. Może to mieć miejsce, gdy występuje regularne zanurzenie, kondensacja, deszcz, ekspozycja na mgłę lub inne źródła wilgoci, które zwilżają i łączą dwa metale.
Jeśli brakuje któregokolwiek z tych elementów, korozja galwaniczna nie może wystąpić. Jeśli, na przykład, bezpośredni kontakt między dwoma metalami jest uniemożliwiony (plastikowa podkładka, powłoka farby itp.) lub jeśli istnieje inna przerwa w ścieżce przewodzącej, nie może wystąpić korozja galwaniczna i każdy metal będzie korodował w normalnym tempie w tym środowisku roboczym. Rysunek 1 pokazuje przykłady warunków, które nie spełniają wszystkich wymagań dla korozji galwanicznej.
Rysunek 1
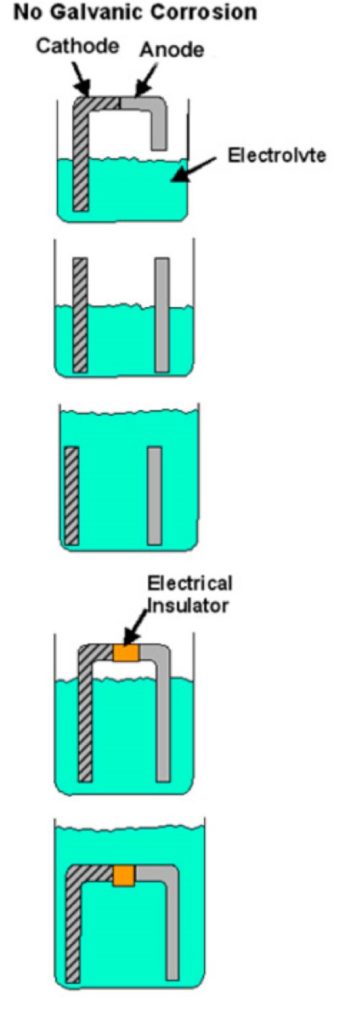
Przykłady połączeń bimetalicznych, w których nie może wystąpić korozja galwaniczna
Gdy dwa różne metale są sprzężone ze sobą w atmosferze lub wodzie, prawdopodobieństwo rozwoju korozji galwanicznej można przewidzieć za pomocą „szeregu galwanicznego”.” W specjalistycznych zastosowaniach, takich jak osadzanie niepodobnych do siebie metali w betonie, należy stosować dane dotyczące korozji dla tego konkretnego środowiska.
Rysunek 2
Rysunek 2 przedstawia szereg galwaniczny zmierzony w wodzie morskiej dla niektórych popularnych metali i stopów. Kiedy dwa metale znajdują się dalej od siebie na liście (np. większa różnica między dwoma liczbami), siła napędowa korozji galwanicznej jest zwiększona. Najbardziej anodowe (aktywne) metale znajdują się na górze, a najbardziej katodowe (szlachetne) na dole. Dla stali nierdzewnych pokazane są zarówno pełne jak i puste pręty. Puste bary reprezentują aktywnie korodującą stal nierdzewną, która ma inny potencjał niż pasywna (nie korodująca) stal nierdzewna. W większości zastosowań, gdzie różne metale są połączone, pasywne (stałe) bar powinien być używany do określenia pozycji stali nierdzewnej.
Na przykład, jeśli cynk (pomyśl stal ocynkowana), który jest aktywny materiał i blisko góry listy i stali nierdzewnej, metalu szlachetnego i blisko dołu listy były w bezpośrednim kontakcie i w obecności elektrolitu (woda), korozja galwaniczna wystąpi, jeśli są one regularnie narażone na elektrolit.
