Obiettivi del caso
- Comprendere i limiti attuali della capacità dei medici di fornire prognosi.
- Elencare le variabili che possono essere usate per guidare le decisioni di trattamento e la prognosi nei pazienti anziani.
- Apprezzare i passi cognitivi per determinare la prognosi nei pazienti anziani.
Caso & Commento: Parte 1
Una donna di 91 anni si è presentata con 2 giorni di nausea e vomito. L’esame fisico ha rivelato una massa palpabile nell’inguine destro senza suoni intestinali. Una TAC dell’addome ha mostrato un’ernia incarcerata complicata da un’ostruzione dell’intestino tenue. La paziente è stata portata in sala operatoria per la resezione in anestesia generale. Dopo l’estubazione, ha sviluppato uno stridore che ha richiesto una nuova intubazione. La valutazione di Otorinolaringoiatria (ENT) non ha rivelato alcuna prova di edema laringeo; tuttavia, c’era la prova della compressione estrinseca significativa della trachea. Una TAC ha rivelato una massa tiroidea. Una biopsia con ago sottile (FNA) è stata eseguita, ma è stata inconcludente. Il medico curante ha tenuto una riunione di famiglia per discutere la prognosi del paziente e la direzione delle cure. Disse alla famiglia che la prognosi era probabilmente molto povera, poiché sospettava un tumore maligno. Data questa notizia, la famiglia ha deciso di non perseguire l’intervento chirurgico (tracheostomia).
I medici sono spesso chiamati a fare previsioni sulla sopravvivenza attesa del paziente e a rivelare queste previsioni ai pazienti. La ricerca ha anche dimostrato che entrambi i tipi di compiti prognostici sono estremamente difficili per i medici.
I risultati di un sondaggio su un campione casuale di 1.311 internisti statunitensi suggeriscono che l’internista medio affronta la domanda “Quanto mi resta da vivere?” dieci volte all’anno, ritira il supporto vitale cinque volte all’anno e indirizza i pazienti alle cure palliative in hospice cinque volte all’anno.(1) Tra questi medici, il 60% ha riferito di trovare la prognostica emotivamente “stressante”, e il loro stress da prognostica era altamente associato all’imprecisione prognostica auto-percepita.
I dati sull’accuratezza prognostica dei medici provengono principalmente da studi di medici che si occupano di pazienti già iscritti alle cure palliative. Questi studi rivelano che, in media, i medici fanno stime prognostiche imprecise; la direzione del loro errore, nella stragrande maggioranza dei casi, è ottimistica, con i medici che sovrastimano la sopravvivenza di un fattore tre.(2-8) In uno studio, 343 medici hanno fornito stime di sopravvivenza per 468 malati terminali di cancro e non-cancro al momento dell’invio del paziente alle cure palliative in hospice. Queste stime sono state poi confrontate con la sopravvivenza effettiva dei pazienti. I medici sono stati accurati nelle loro prognosi circa il 20% delle volte, hanno sovrastimato la sopravvivenza più di tre volte più spesso (63%), e hanno sottostimato la sopravvivenza solo in una minoranza di casi (17%).(8)
La ricerca si è chiesta se tale sistematica sovrastima prognostica da parte dei medici possa in parte spiegare le sopravvivenze inaspettatamente “brevi” osservate nei pazienti indirizzati alle cure palliative in Hospice. I risultati dell’indagine di cui sopra suggeriscono che i medici ritengono che la durata ottimale della permanenza in Hospice sia di 3 mesi (9), eppure la durata mediana della permanenza osservata è di sole 3 settimane.(8) Forse parte di questa incoerenza osservata deriva da un pregiudizio ottimistico dei medici nella prognosi.
Questa particolare paziente era diversa da quelle arruolate negli studi sopra menzionati in quanto non aveva ancora una “malattia terminale” accertata. Poiché la scienza della prognosi è ancorata alla diagnosi e all’estensione della malattia, l’ambiguità diagnostica di questa paziente ha contribuito a rendere la prognosi piuttosto difficile. Da un lato, se la massa sul collo della paziente fosse il risultato di un cancro anaplastico della tiroide (cioè una forma rara e rapidamente fatale di cancro della tiroide), la sua sopravvivenza mediana stimata sarebbe di circa 4 mesi (10), e l’istituzione immediata di cure di supporto (e non curative) sarebbe un approccio clinico appropriato per gestire la compromissione delle vie aeree. D’altra parte, se la sua massa sul collo fosse il risultato di un gozzo benigno, la sua sopravvivenza mediana stimata sarebbe probabilmente molto simile alla sua sopravvivenza attesa in base all’età di circa 4 anni (11), e l’istituzione di cure di supporto non sarebbe un approccio convenzionale alla gestione della compromissione delle vie aeree. A seconda delle caratteristiche del gozzo (per esempio, diffuso, multinodulare) e dell’approccio dell’endocrinologo (per esempio, prova della terapia soppressiva del T4, chirurgia riduttiva e/o iodio radioattivo), altri approcci sarebbero più convenzionali.
Dato l’intervallo prognostico molto ampio associato alla massa del collo di questo paziente – 4 mesi contro 4 anni – e l’ampio intervallo associato di approcci clinici, per questo paziente, una diagnosi dei tessuti aiuterebbe a ridurre questo intervallo prognostico e quindi a definire meglio l’approccio clinico immediato. Anche se un clinico potrebbe essere tentato di assumere che una grande massa sia cancerosa, gli studi di aspirazioni tiroidee consecutive negli ospedali comunitari suggeriscono che il cancro spiega solo dal 5% al 6,5% (12,13) dei noduli.
Caso & Commento: Parte 2
Dopo ulteriori discussioni, la famiglia ha deciso di ritirare le cure, perché la paziente aveva dichiarato in precedenza che non voleva essere intubata per un lungo periodo. Poco dopo l’estubazione, la paziente è morta. Pochi giorni dopo la morte della paziente, furono ottenuti i risultati del secondo FNA. La biopsia ha rivelato un gozzo nodulare benigno.
Il paziente, la famiglia e il medico in questa vignetta hanno vissuto la situazione non comune di un errore prognostico pessimistico. Gli eventi descritti sono sorprendenti e sollevano una domanda importante: perché è stato fatto l’FNA se i suoi risultati non avrebbero influenzato la cura?
Una preoccupazione naturale in questo caso è se l’età avanzata del paziente abbia in qualche modo influenzato la decisione di perseguire un approccio diagnostico meno completo. È certamente difficile immaginare che una donna di 37 anni sarebbe stata gestita in questo modo. Tuttavia, è possibile che ci fossero altre comorbidità limitanti la vita (per esempio, un cancro avanzato precedentemente diagnosticato, una grave demenza, un’insufficienza cardiaca congestizia di classe IV) e/o un cattivo stato funzionale che hanno influenzato la sua prognosi di base e quindi potrebbero spiegare l’approccio clinico.
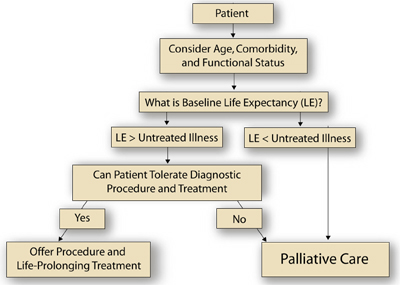
Un approccio clinico generale a questo paziente può essere preso in prestito dal campo dell’oncologia, che attualmente sta lottando per sviluppare approcci sistematici o algoritmi che riconoscano e integrino importanti variabili prognostiche (sia legate al cancro che non) per guidare le decisioni di trattamento del cancro nei pazienti anziani.(14) Per esempio, una valutazione geriatrica completa (CGA) può fornire informazioni sullo stato funzionale e sulle comorbidità, che, insieme al sesso e all’età cronologica, hanno rilevanza prognostica e possono essere integrate per generare una stima dell’aspettativa di vita di base.(14) Il medico confronta la sopravvivenza attesa dalla malattia o dalle malattie non trattate che si stanno considerando (per esempio, cancro anaplastico della tiroide contro gozzo benigno) con questa stima dell’aspettativa di vita di base. Se l’aspettativa di vita di base è maggiore di quella della condizione non trattata, il medico deve poi decidere se la procedura diagnostica e/o il trattamento specifico della malattia comporterebbe un eccesso di morbilità e mortalità (cioè, decidere se gli interventi sono “tollerabili”). Se la tolleranza della procedura diagnostica e/o la tolleranza del trattamento è ritenuta adeguata, allora il paziente può beneficiare di un ulteriore lavoro e, infine, di una terapia diretta alla malattia o alla malattia in esame.
In questo caso, non vengono fornite informazioni sulla comorbilità o sullo stato funzionale, ma sappiamo che il paziente era una donna di 91 anni. Le tabelle di vita indicano che il 50% delle donne americane di 90 anni vivrà almeno altri 3,8 anni, il 25% vivrà meno di 1,8 anni e il 25% almeno 6,8 anni. Poiché la sopravvivenza prevista per il cancro alla tiroide più aggressivo (cioè, istologia anaplastica) è di soli 4 mesi e la sopravvivenza prevista per la spiegazione più benigna della massa sul collo (cioè, gozzo benigno) è improbabile che abbia un impatto significativo sulla speranza di vita, la maggior parte degli algoritmi raccomanderebbe la biopsia. Se d’altra parte, il paziente avesse già una malattia gravemente limitante la vita (per esempio, un cancro ai polmoni al IV stadio), i risultati della biopsia non avrebbero un impatto sul processo decisionale e quindi non sarebbero necessari. In quest’ultimo caso, la cura di supporto per il cancro ai polmoni sarebbe un approccio appropriato. La Figura delinea un approccio a tale processo decisionale clinico per i pazienti anziani con cancro.
Quando si fanno stime prognostiche nei pazienti anziani, è importante considerare le seguenti questioni:
- Qual è la diagnosi e l’estensione della nuova malattia?
- Qual è l’aspettativa di vita di base del paziente in relazione all’età, comorbidità e stato funzionale?
- La sopravvivenza prevista per la nuova malattia è più breve dell’aspettativa di vita di base?
- Il trattamento migliorerà la sopravvivenza prevista per la nuova malattia?
- Il trattamento per la nuova malattia sarà tollerato?
La prognosi è un compito difficile. La maggior parte dei medici non sono in grado di prevedere accuratamente la sopravvivenza e sono a disagio con questo processo. Un approccio basato sull’evidenza dovrebbe essere impiegato quando possibile, avendo cura di rimuovere l’effetto dei pregiudizi dall’algoritmo, ma sono necessarie ulteriori ricerche per sviluppare algoritmi predittivi clinicamente utili.(16-20)
Elizabeth B. Lamont, MD, MS Assistant Professor of Medicine Harvard Medical School Massachusetts General Hospital Cancer Center and Institute of Technology Assessment
Faculty Disclosure: La dottoressa Lamont ha dichiarato che né lei, né alcun membro immediato della sua famiglia, ha un accordo finanziario o altre relazioni con i produttori di qualsiasi prodotto commerciale discusso in questa attività di formazione medica continua. Inoltre, il suo commento non include informazioni riguardanti l’uso sperimentale o off-label di prodotti farmaceutici o dispositivi medici.
1. Christakis NA, Iwashyna TJ. Atteggiamento e pratica auto-riferita riguardo alla prognosi in un campione nazionale di internisti. Arch Intern Med. 1998;158:2389-95.
2. Christakis NA, Lamont EB. Estensione e fattori determinanti dell’errore nelle prognosi dei medici nei malati terminali: studio prospettico di coorte. BMJ. 2000;320:469-72.
3. Parkes CM. Accuratezza delle previsioni di sopravvivenza negli ultimi stadi del cancro. BMJ. 1972;2:29-31.
4. Evans C, McCarthy M. Incertezza prognostica nella cura terminale: l’indice Karnofsky può aiutare? Lancet. 1985;1:1204-6.
5. Heyse-Moore LH, Johnson-Bell VE. I medici possono prevedere accuratamente l’aspettativa di vita dei pazienti con cancro terminale? Palliat Med. 1987;1:165-6.
6. Forster LE, Lynn J. Predire la durata della vita per i candidati all’hospice ricoverati. Arch Intern Med. 1988;148:2540-3.
7. Maltoni M, Nanni O, Derni S, et al. La predizione clinica della sopravvivenza è più accurata del Karnofsky performance status nella stima della durata della vita dei pazienti oncologici terminali. Eur J Cancer. 1994;30A:764-6.
8. Christakis NA, Lamont EB. Estensione e fattori determinanti dell’errore nelle prognosi dei medici nei malati terminali: studio prospettico di coorte. BMJ. 2000;320:469-72.
9. Iwashyna TJ, Christakis NA. Atteggiamento e pratica auto-riferita riguardo al rinvio all’hospice in un campione nazionale di internisti. J Palliat Med. 1998;1:241-8.
10. Seesions RB, Burman KD. Cancro della ghiandola tiroidea. In: Harrison LB, Sessions RB, Hong KW, eds. Cancro della testa e del collo. 2a ed. Filadelfia, PA: Lippincott Williams & Wilkins; 2004.
11. Walter LC, Covinsky KE. Lo screening del cancro nei pazienti anziani: un quadro per il processo decisionale individualizzato. JAMA. 2001;285:2750-6.
12. Belfiore A, Giuffrida D, La Rosa GL, et al. Alta frequenza di cancro in noduli tiroidei freddi che si verificano in giovane età. Acta Endocrinol (Copenh). 1989;121:197-202.
13. Belfiore A, Giuffrida D, La Rosa GL, et al. Alta frequenza di cancro nei noduli tiroidei freddi che si verificano in giovane età. Acta Endocrinol (Copenh). 1989;121:197-202.
14. Repetto L, Granetto C, Venturino A, Rosso R, Gianni W, Santi L. Valutazione prognostica del paziente oncologico anziano. In: Balducci L, Lyman GH, e Ershler WB, eds. Oncologia geriatrica completa. 1a ed. Amsterdam, Paesi Bassi: The Netherlands Harwood Academic Publishers; 1998:287-300.
15. Balducci L. Abbiamo bisogno dell’oncologia geriatrica? Cancer Control. 1994;1:91-93.
16. Lamont EB, Christakis NA. Stime di sopravvivenza nel cancro avanzato. In: Rose BD, ed. UpToDate (versioni 10.2-10.3). UpToDate. Wellesley, MA; 2002. Disponibile a: . Accessed August 17, 2004.
17. Lamont EB, Christakis NA. Prognostica nella malattia avanzata. In: Berger A, Portenoy RK, Weissman DE, eds. Principi e pratica delle cure palliative e dell’oncologia di supporto. 2a ed. Filadelfia, PA: Lippincott Williams and Wilkins; 2002.607-14.
18. Fox E, Landrum-McNiff K, Zhong Z, Dawson NV, Wu AW, Lynn J. Valutazione dei criteri prognostici per determinare l’idoneità all’hospice nei pazienti con malattia polmonare, cardiaca o epatica avanzata. Investigatori SUPPORT. Studio per capire le prognosi e le preferenze per i risultati e i rischi dei trattamenti. JAMA. 1999;282:1638-45.
19. Schonwetter RS, Han B, Small BJ, Martin B, Tope K, Haley WE. Predittori di sopravvivenza a sei mesi tra i pazienti con demenza: una valutazione delle linee guida di Hospice Medicare. Am J Hosp Palliat Care. 2003;20:105-13.
20. Arias E. Tabelle di vita degli Stati Uniti, 2000. . 2002;51:29-33. Disponibile presso: . Accessed August 17, 2004.
Figura
Figura. Un algoritmo per il trattamento di pazienti oncologici anziani