
Definition
Quando dois metais ou ligas diferentes são imersos numa solução corrosiva ou regularmente ligados por humidade, cada um desenvolverá um potencial de corrosão. Se as condições de corrosão galvânica estiverem presentes, o metal mais nobre tornar-se-á o cátodo e o metal mais activo tornar-se-á o ânodo. Uma corrente mensurável pode fluir entre o ânodo e o cátodo. Se isto ocorrer, a taxa de corrosão do ânodo no ambiente de serviço será aumentada enquanto que a taxa de corrosão do cátodo irá diminuir. O aumento da corrosão do ânodo é chamado “corrosão galvânica”
Corrosão galvânica é por vezes utilizada para prolongar a vida útil dos materiais (ou seja, revestimentos de zinco em aço-carbono e ânodos de zinco em aquecedores de água), mas, se não for considerada e existirem as condições certas, pode levar a falhas inesperadas.
Requisitos para a Corrosão Galvânica:
Para que ocorra corrosão galvânica, são necessários três elementos.
- Dois metais com diferentes potenciais de corrosão
- Contacto eléctrico directo metal-metal
- Uma solução electrolítica condutora (por exemplo, água) deve ligar os dois metais numa base regular. A solução electrolítica cria uma “via condutora”. Isto pode ocorrer quando há imersão regular, condensação, chuva, exposição a nevoeiro ou outras fontes de humidade que amortecem e ligam os dois metais.
Se algum destes elementos faltar, não pode ocorrer corrosão galvânica. Se, por exemplo, o contacto directo entre os dois metais for evitado (lavador de plástico, película de tinta, etc.) ou se houver alguma outra interrupção no caminho condutor, não pode haver corrosão galvânica e cada metal irá corroer à sua velocidade normal nesse ambiente de serviço. A figura 1 mostra exemplos de condições que não satisfazem todos os requisitos de corrosão galvânica.
Figure 1
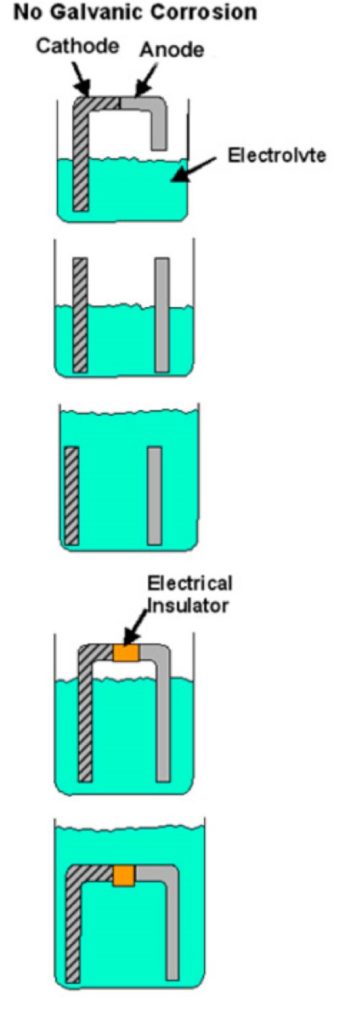
Exemplos de combinações bimetálicas quando a corrosão galvânica não pode ocorrer
Quando dois metais diferentes estão acoplados juntos na atmosfera ou na água, a probabilidade de desenvolver corrosão galvânica pode ser prevista usando uma “série galvânica”.” Em aplicações especializadas, tais como quando metais diferentes são incorporados no betão, devem ser utilizados dados de corrosão para esse ambiente específico.
Figure 2
Figure 2 mostra a série galvânica medida em água do mar para alguns metais e ligas comuns. Quando dois metais estão mais afastados na lista (por exemplo, uma diferença maior entre os dois números), a força motriz da corrosão galvânica é aumentada. Os metais mais anódicos (activos) estão no topo e os mais catódicos (nobres) no fundo. Tanto as barras sólidas como as ocas são mostradas para os aços inoxidáveis. As barras ocas representam aço inoxidável activamente corroído, que tem um potencial diferente do aço inoxidável passivo (não corroído). Na maioria das aplicações, onde metais diferentes são combinados, a barra passiva (sólida) deve ser utilizada para determinar a posição do aço inoxidável.
Por exemplo, se o zinco (pense em aço galvanizado) que é um material activo e próximo do topo da lista e o aço inoxidável, um metal nobre e próximo do fundo da lista estiverem em contacto directo e na presença de um electrólito (água), ocorrerá corrosão galvânica se forem regularmente expostos a um electrólito.
