Introduzione
| Classe di salinità | S |
| Hyperhaline | > 65 |
| Metahaline | 45-65 |
| Euhaline | 30-35 |
| Polyhaline | 18-30 |
| Mesohaline | 5-18 |
| Oligohaline | 0.5-5 |
La salinità dell’acqua marina è definita come la quantità totale in peso di sali disciolti in un chilogrammo di acqua marina. La salinità è espressa nell’unità g / kg, che è spesso scritta come ppt (parte per mille) o ‰ (permil). I sali dissolti in acqua di mare sono dissociati nei loro ioni; gli ioni predominanti sono il cloruro e il sodio; altri ioni significativi sono il magnesio, il solfato, il calcio e il potassio. Nel corso degli anni, sono stati sviluppati vari metodi per determinare la salinità. Il metodo più pratico attualmente usato è attraverso la conducibilità elettrica. Poiché questo è un metodo indiretto, è stata stabilita una relazione accurata tra la conducibilità e la salinità. La salinità determinata in questo modo è una quantità senza dimensione che è chiamata salinità pratica. Secondo la scala della salinità pratica, la tipica acqua di mare “standard” ha una salinità di 35. Per ottenere una migliore coerenza con la termodinamica dell’acqua di mare, nel 2010 è stata introdotta una nuova scala di salinità, la cosiddetta scala di salinità assoluta. La piccola correzione numerica della scala di salinità pratica che questo comporta non è di grande importanza pratica per le acque costiere, dove è annullata dalla forte variabilità della salinità nello spazio e nel tempo. Tuttavia, una grande precisione è necessaria per l’oceano, perché piccole differenze di salinità possono essere molto rilevanti per la circolazione oceanica su larga scala e la caratterizzazione delle masse d’acqua.
L’acqua marina è più densa dell’acqua dolce a causa del peso aggiunto dei sali disciolti; la relazione tra salinità e densità è trattata nell’articolo Densità dell’acqua marina). Questo articolo dà una panoramica delle diverse scale di salinità. I sensori usati per le misure di conducibilità sono discussi nell’articolo Sensori di salinità.
Misure e definizioni di salinità nella storia
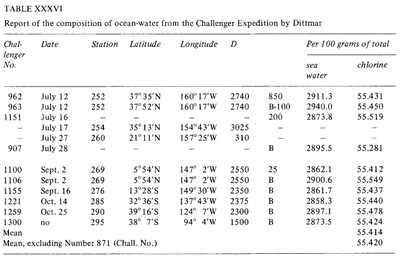
Composizione costante dell’acqua marina (Dittmar, 1884)
Fino dai tempi dell’Antica Grecia, sono stati fatti dei tentativi per misurare la “salinità” dell’acqua marina. Tuttavia, questi primi metodi non erano molto efficienti e la loro sensibilità e ripetibilità erano molto limitate. Durante la storia moderna sono state sviluppate metodologie più precise: pesatura dopo evaporazione (Boyle, 1693; Birch, 1965), estrazione con solvente (Lavoisier, 1772) e precipitazione (Bergman, 1784). Nel 1865, Forchhammer introdusse il termine salinità e si dedicò a misurare i singoli componenti del sale marino piuttosto che la salinità totale. Trovò che il rapporto tra i sali principali nei campioni di acqua di mare di varie località era costante. Questo rapporto costante è noto come principio di Forchhammer, o principio delle proporzioni costanti. Verso la fine del XIX secolo, William Dittmar, seguendo il lavoro di Forchhammer, provò diversi metodi per analizzare la salinità e la composizione chimica dell’acqua di mare. I metodi di Dittmar per l’analisi chimica dell’acqua di mare erano estremamente precisi. Dittmar analizzò il contenuto di cloro nell’acqua di mare usando la precipitazione di nitrato d’argento del cloruro, e lo confrontò con campioni di acqua di mare preparati sinteticamente per valutare la precisione del metodo. In seguito analizzò 77 campioni provenienti da tutto il mondo, presi durante la spedizione Challenger e notò la stessa costanza di composizione osservata da Forchhammer: “anche se la concentrazione delle acque è molto diversa, la composizione percentuale del materiale disciolto è quasi la stessa in tutti i casi”. .
Definizione di salinità 1902
Con tecniche più accurate per misurare la salinità, ci fu la necessità di avere la stessa definizione di salinità e metodi di misurazione in tutta la comunità scientifica. Nel 1889, Martin Knudsen fu nominato dal CIEM a presiedere una commissione per affrontare i problemi di salinità. Egli formulò la seguente definizione:
“La salinità è la quantità totale di materiali solidi, in grammi, dissolti in un chilogrammo di acqua di mare quando tutto il carbonato è stato convertito in ossido, il bromo e lo iodio sostituiti dal cloro e tutta la materia organica completamente ossidata.
Anche se questa definizione è corretta ed è servita agli oceanografi per i successivi 65 anni, la metodologia è poco pratica e difficile da eseguire con precisione. Sapendo che gli ioni maggiori rimangono in proporzioni costanti l’uno con l’altro e che il cloro potrebbe essere misurato accuratamente con la titolazione volumetrica dell’argento, la commissione ha definito la “clorinità” come una misura della salinità. Originariamente, la salinità era calcolata dal contenuto di Cl- (clorinità). La clorinità è misurata come la massa in g di alogenuri che può essere precipitata da 1.000 g di acqua di mare da Ag+ usando una soluzione standard di AgNO3. La reazione è:
AgNO3 (aq) + NaCl (aq) → AgCl(s) + NaNO3 (aq)
Dopo aver analizzato un gran numero di campioni da nove località, Knudsen e i suoi colleghi hanno sviluppato un’equazione per calcolare la salinità basata sul contenuto di cloro:
S = 1,805 \, Cl^- + 0,03 \; g / kg , \qquad (1)
dove la clorinità Cl- è definita come la massa di argento necessaria per precipitare completamente gli alogeni in 0,3285234 kg del campione di acqua di mare:
Cl- = 328.5234 Ag+
Le misure di salinità sono talvolta espresse nella scala della clorinità (g Cl- / kg) o nella scala della clorosità (g Cl- / l).
Definizione rivista della salinità 1966
Come visto dalla formula (1), questo metodo ha i suoi limiti e non è completamente corretto: quando la clorinità è 0, la salinità è 0,03. Inoltre, Carritt e Carpenter (1959) hanno stimato che l’incertezza di un valore calcolato di salinità da un valore misurato di clorinità utilizzando questa relazione può essere fino a 0,04 g / kg. Questo è dovuto alle variazioni nella composizione chimica in alcuni campioni di acqua di mare (Baltico) e al fatto che solo 9 luoghi diversi sono stati campionati per definire la clorinità.All’inizio degli anni ’60, con lo sviluppo di ponti di conducibilità, è diventato possibile misurare la salinità con grande precisione (± 0,003 g / kg). I ponti davano rapporti di conducibilità tra il campione e l’acqua di mare standard usata per calibrare i ponti. Tuttavia l’acqua di mare standard era stata sviluppata per le misure di clorinità e non per la conducibilità, quindi un nuovo standard di conducibilità fu commissionato al Joint Panel for Oceanographic Tables and Standards (JPOTS). Sulla base di nuove misurazioni di salinità, temperatura e conducibilità da campioni di tutto il mondo, la formula standard della clorinità è stata rivista in:
S = 1,80655 \, Cl^- . \qquad (2)
Practical Salinity Scale-1978 / EOS-80
WHAT IS PSU? di Frank J. Millero in Oceanography Magazine, 1993
Dopo aver ricevuto l’ultimo numero di Oceanography, sono stato irritato dalla pubblicità della Sea-Bird sulla copertina interna. Mostra un diagramma TS che è etichettato con il termine PSU. Anche se non ho avuto successo nel convincere l’azienda a interrompere l’uso di questo termine, ho pensato di scrivere questa lettera per esprimere le mie preoccupazioni circa il suo utilizzo da parte dei miei oceanografi negli articoli pubblicati. Il termine apparentemente è usato per indicare l’uso della Practical Salinity Scale ed è un’abbreviazione di Practical Salinity Unit. Come membro del Joint Panel on Oceanographic Tables and Standards che è stato determinante nello sviluppo dell’equazione internazionale dello stato dell’acqua di mare e della scala di salinità pratica, sono stupito che la pratica che sembra essere stata adottata dagli oceanografi nell’usare PSU. La scala di salinità pratica è stata definita come rapporto di conducibilità senza unità. Un campione di acqua di mare con un rapporto di conducibilità di 1,0 a 15ºC con una soluzione di KCl contenente una massa di 32,4356 g in una massa totale di 1 kg di soluzione ha una salinità di 35,000 (non servono unità o ‰). La dipendenza dalla salinità e dalla temperatura di questo rapporto per il peso dell’acqua di mare evaporata o diluita con acqua ha portato alla definizione completa della scala di salinità pratica. Questa definizione è stata adottata da tutte le organizzazioni oceanografiche nazionali e internazionali. Da qualche parte lungo la linea gli oceanografi cominciarono ad usare il termine PSU (unità di salinità pratica) per indicare che la scala di salinità pratica era usata per determinare la salinità di conducibilità. Questo apparentemente derivò dall’uso precedente del ‰ per rappresentare le parti per mille, che alcuni oceanografi ritenevano essere un’unità. La linea di fondo è che la salinità è sempre stata un rapporto e non ha unità fisiche. L’uso del termine PSU non dovrebbe essere permesso sul campo e certamente non dovrebbe essere usato negli articoli pubblicati. Ogni volta che si usa la scala di salinità pratica per determinare la salinità, questo dovrebbe essere dichiarato da qualche parte nel documento. L’uso del termine PSS può essere usato per indicare che viene usata la scala di salinità pratica. Non si deve certamente usare il termine PSU su tutte le figure che mostrano dati TS. Devo anche sottolineare che l’UNESCO (1985) ha pubblicato un rapporto SUN che delinea attentamente l’uso delle unità nel campo dell’oceanografia. Questo rapporto è stato anche adottato da tutte le Società Oceanografiche Internazionali ma non è generalmente usato dagli oceanografi e dalle riviste che pubblicano dati oceanografici. Se il campo dell’oceanografia deve diventare una scienza riconosciuta, deve adottare le unità che sono fondamentali per i campi della chimica e della fisica. Inoltre non dovrebbe adottare nuove unità per le variabili che sono senza unità.
Il rapporto di peso dei vari sali disciolti nell’acqua di mare è quasi lo stesso ovunque negli oceani del mondo. Questo vale anche per le acque costiere, anche se le deviazioni dalla composizione standard diventano più importanti a bassa salinità nella zona di transizione sale-fresco. A causa della composizione approssimativamente universale dei sali dissolti nell’acqua di mare, la salinità dell’acqua di mare può essere derivata dal grado di diluizione dell’acqua di mare con acqua dolce. Questo è fatto più convenientemente misurando la conducibilità C. La scala di salinità pratica (PSS) è stata introdotta per stabilire una relazione univoca tra salinità e conducibilità. Questa relazione si basa sul rapporto R della conducibilità dell’acqua di mare e la conducibilità C(35,15) di una soluzione standard di 1 kg contenente 32,4356 g KCl a 15oC, che ha salinità S=35.
La relazione tra la salinità S(T) e il rapporto di conducibilità R=R(S,T) è stata basata su precise determinazioni della clorinità e del rapporto di conducibilità per diverse temperature T su 135 campioni di acqua di mare naturale, tutti raccolti entro 100 m dalla superficie, e includendo campioni da tutti gli oceani e dai mari Baltico, Nero, Mediterraneo e Rosso. Dopo che la clorinità è stata convertita in salinità, utilizzando la relazione (2), il seguente polinomio è stato calcolato dai minimi quadrati:
S(T) = S(15) + \Delta S(T) , \qquad R=\Large\frac{C(S,T)}{C(35,15)}normalsize , \qquad (3)
S(15)=0.008-0.1692\,R^{1/2}+25.3851\,R+14.0941\,R{3/2}-7.0261\,R^2+2.7081\,R^{5/2} , \qquad (4)
Delta S(T)= \Large\frac{T-15}{1+0.0162(T-15)}\normalsize (0.0005-0.0056\,R^{1/2} \\ -0.0066\,R-0.0375\,R^{3/2}+0.0636\,R^2-0.0144\,R^{5/2}) , \qquadro (5)
per 2 \le S \le \le, 42 e per la pressione atmosferica,
S(15) \approx 0.586 \, C^{1.0876} Tuttavia, poiché la conducibilità assoluta non può essere misurata con la precisione richiesta per misure precise di salinità, è consigliabile utilizzare la conducibilità misurata rispetto a quella dell’acqua di mare standard e applicare le relazioni salinità-conduttività (3-5).
La Practical Salinity Scale è stata adottata nel 1980 come standard internazionale per l’oceanografia dall’UNESCO/SCOR/ICES/IAPSO Joint Panel on Oceanographic Tables and Standards e SCOR Working Group 51 (JPOTS). La corrispondente Equazione di Stato dell’Acqua di Mare (EOS-80) basata sulla scala di temperatura IPTS-68 e sulla Practical Salinity Scale 1978, PSS-78 (Lewis e Perkin, 1981) fu pubblicata da Millero et al. (1980).
TEOS-10
Il CIO dell’UNESCO ha introdotto nel 2010 una nuova definizione di salinità, la cosiddetta Salinità Assoluta S_A. L’equazione termodinamica di stato (TEOS) è stata aggiornata per diversi motivi :
- Diverse espressioni polinomiali dell’Equazione Internazionale di Stato dell’Acqua di Mare (EOS-80) non sono completamente coerenti tra loro, poiché non obbediscono esattamente alle relazioni termodinamiche di Maxwell di differenziazione incrociata. Il nuovo approccio elimina questo problema.
- Dalla fine degli anni ’70 è apparsa una descrizione termodinamica più accurata dell’acqua pura (IAPWS-95). Inoltre sono state effettuate misurazioni maggiori e piuttosto accurate delle proprietà dell’acqua di mare (come per (i) la capacità termica, (ii) la velocità del suono e (iii) la temperatura di massima densità) che possono essere incorporate in una nuova descrizione termodinamica dell’acqua di mare.
- L’impatto sulla densità dell’acqua di mare della variazione della composizione dell’acqua di mare nei diversi bacini oceanici è stata meglio compresa.
- L’enfasi crescente sull’oceano come parte integrante del motore termico globale indica la necessità di espressioni accurate per l’entalpia e l’energia interna dell’acqua di mare in modo che i flussi di calore possano essere determinati più accuratamente nell’oceano (entalpia ed energia interna non erano disponibili da EOS-80).
- La scala della temperatura è stata rivista da ITS-68 a ITS-90 e i pesi atomici degli elementi sono stati rivisti.
La Salinità Assoluta S_A è definita come la frazione di massa di materiale disciolto non-H2O in un campione di acqua marina alla sua temperatura e pressione ed espressa in unità g / kg. Pertanto è anche indicato come salinità di densità. La frazione di massa di H2O in un campione di acqua di mare è quindi data da 1-0.001 S_A. Questa definizione affronta correttamente la questione “cosa costituisce l’acqua e cosa il materiale disciolto” (per esempio, la dissoluzione di una data massa di CO2 in acqua pura essenzialmente trasforma parte dell’acqua in materiale disciolto perché produce una miscela di CO2, H2CO3, HCO3-, CO32-, H+, OH- e H2O, con le proporzioni relative che dipendono dalle costanti di dissociazione che dipendono dalla temperatura, pressione e pH.).
I valori della salinità assoluta S_A differiscono solo leggermente dai corrispondenti valori della salinità pratica S. Per l’acqua di mare di composizione standard di riferimento
S_A = \Large\frac{35.16504}{35}normalsize S \; g / kg \qquad (6).
In altre parole, per un campione di acqua di mare di riferimento con salinità pratica 35 la salinità assoluta è 35,16504 g / kg. Per l’acqua di mare non standard raccolta in luoghi arbitrari dell’oceano, la differenza media tra la Salinità Assoluta S_A e l’Eq. (6) è circa 0,0107 g/kg. Il valore della Salinità Assoluta S_A espresso in g / kg e il corrispondente valore della Salinità Pratica S sono noti per differire da non più di circa 0,5%. L’uso della salinità pratica ha il vantaggio di essere (quasi) direttamente determinata da misure di conducibilità, temperatura e pressione, mentre la salinità assoluta è generalmente derivata da una combinazione di queste misure più altre misure e correlazioni che spesso non sono ben stabilite.
Impatto biologico della salinità

Osmosi attraverso una membrana semipermeabile che permette alle molecole di acqua (blu) di passare più facilmente di quelle di sale (rosso). Attraverso la membrana passano più molecole d’acqua nel compartimento dell’acqua di mare che molecole di sale nel compartimento dell’acqua dolce, fino a quando la concentrazione di sale è uguale su entrambi i lati della membrana. Questo aumenta la pressione nel compartimento dell’acqua di mare, la cosiddetta pressione osmotica. Adattato da ZME Science.
Tutti gli organismi devono mantenere un equilibrio tra acqua e soluti nel loro corpo per mantenere vive le loro cellule. Questo si chiama omeostasi. Per regolare questo, possono importare ed esportare soluti attraverso le loro membrane che sono permeabili alle sostanze che sono dissolte o sospese nell’acqua. Il movimento casuale delle sostanze dissolte attraverso una membrana permeabile è chiamato diffusione. La diffusione avviene finché le concentrazioni sono uguali su entrambi i lati della membrana. Quando un soluto non può passare attraverso la membrana, l’uguaglianza della concentrazione su entrambi i lati è raggiunta dal movimento netto dell’acqua attraverso la membrana. Il movimento netto dell’acqua attraverso una membrana semipermeabile in risposta alle differenze di concentrazione del soluto è chiamato “osmosi”. Questo è essenziale per la sopravvivenza delle cellule. Nel caso di una concentrazione di sale più alta all’esterno che all’interno, la cellula perderà acqua, si disidraterà e morirà. Nel caso opposto, la cellula assorbirà acqua, si gonfierà ed eventualmente scoppierà. Per questo motivo, gli organismi investono tempo ed energia per mantenere l’omeostasi.
Sensori di salinità Densità dell’acqua marina Intrusione e miscelazione dell’acqua marina negli estuari Circolazione estuarina Estuari a cuneo salino Scambio del mare di piattaforma con l’oceano
Si noti che anche altri possono aver modificato il contenuto di questo articolo.
- Per altri articoli di questo autore vedi Categoria:Articoli di Souza Dias, Francisco
- Per altri articoli di questo autore vedi Categoria:Articoli di TÖPKE, Katrien
- Per una panoramica dei contributi di questo autore vedi Special:Contributions/Francisco Souza Dias
- Per una panoramica dei contributi di questo autore vedi Special:Contributi/Ktopke