Un sistema si riferisce a qualsiasi parte dell’universo oggetto di studio.
Se stai conducendo un esperimento in un becher, allora il sistema che stai studiando è nel becher.
Il sistema è soggetto a fattori circostanti come la temperatura e la pressione dell’aria.
La termodinamica riguarda lo studio dello scambio di energia termica tra un sistema e il suo ambiente.
Ci sono tre tipi di sistemi termodinamici. In base al possibile trasferimento di calore e materia, sono classificati come sistemi aperti, chiusi o isolati.
Tipi di sistemi termodinamici
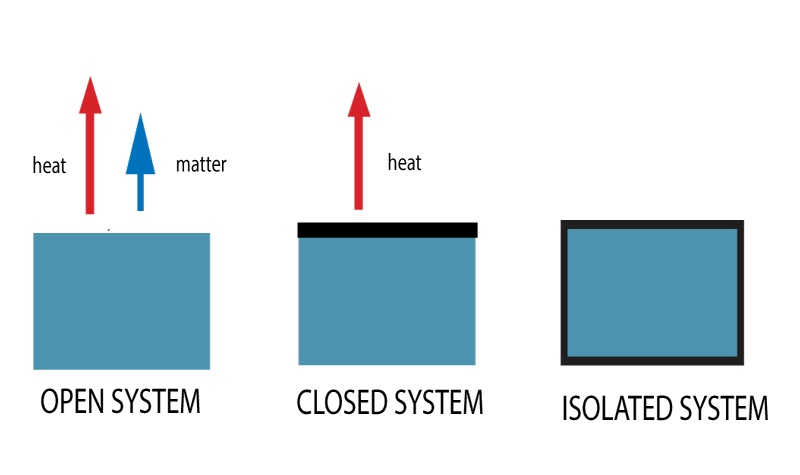
Sistemi aperti
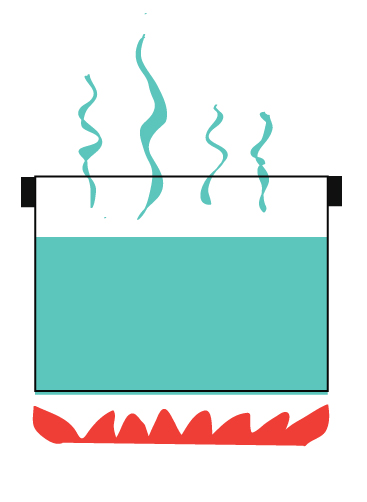
Avrai sentito parlare di sistemi aperti e sistemi chiusi. Un sistema aperto è un sistema che permette liberamente sia all’energia che alla materia di essere trasferita dentro e fuori un sistema.
Per esempio, acqua bollente senza coperchio.
Calore che sfugge nell’aria.
Vapore (che è materia) che sfugge nell’aria.
Sistemi chiusi
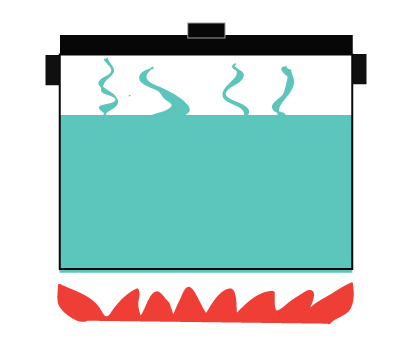
Un sistema chiuso, invece, non permette lo scambio di materia ma consente il trasferimento di energia.
Consente il trasferimento di calore dal fornello all’acqua
Il calore viene trasferito anche all’ambiente circostante
Il vapore non può fuoriuscire
Esempio di un sistema chiuso – una pentola a pressione.
Nb: If a system is 100% closed, it is in danger of exploding. That's why a pressure cooker should be designed with safety mechanisms to prevent the system from over-pressurzing by allowing steam to escape when needed.
Sistemi isolati
Questo sistema è completamente sigillato.
Né la materia né il calore possono trasferirsi verso o dall’ambiente circostante.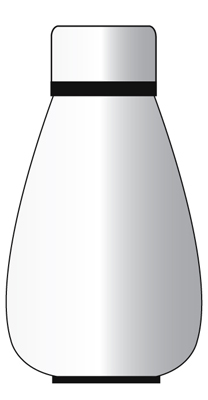 Esempio – Un thermo flask.
Esempio – Un thermo flask.
Lo scopo di un thermo flask è quello di mantenere il cibo caldo.
Un thermoplak può essere considerato un sistema isolato, ma solo per un breve periodo di tempo.
Impedisce che sia il calore che la materia siano trasferiti all’ambiente circostante.
In definitiva, il calore nel thermoplak uscirà verso l’ambiente circostante e il contenuto del thermoplak si raffredderà.