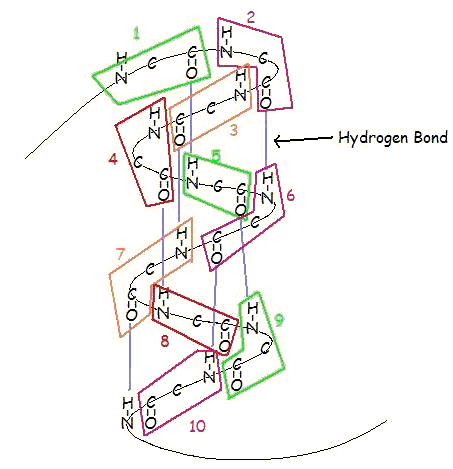
Un’α-elica è una spirale destrorsa di residui di amminoacidi su una catena polipeptidica, tipicamente compresa tra 4 e 40 residui. Questa spirale è tenuta insieme da legami a idrogeno tra l’ossigeno di C=O sulla spirale superiore e l’idrogeno di N-H sulla spirale inferiore. Un tale legame a idrogeno si forma esattamente ogni 4 residui di aminoacidi, e ogni giro completo dell’elica è di soli 3,6 residui di aminoacidi. Questo schema regolare dà all’α-elica caratteristiche molto definite per quanto riguarda lo spessore della spirale e la lunghezza di ogni giro completo lungo l’asse dell’elica.
L’integrità strutturale di un’α-elica dipende in parte dalla corretta configurazione sterica. Gli amminoacidi i cui gruppi R sono troppo grandi (triptofano, tirosina) o troppo piccoli (glicina) destabilizzano le α-eliche. Anche la prolina destabilizza gli α-elici a causa della sua geometria irregolare; il suo gruppo R si lega all’azoto del gruppo amidico, il che provoca un ostacolo sterico. Inoltre, la mancanza di un idrogeno sull’azoto della prolina gli impedisce di partecipare al legame a idrogeno.
Un altro fattore che influenza la stabilità delle α-eliche è il momento di dipolo totale dell’intera elica dovuto ai dipoli individuali dei gruppi C=O coinvolti nel legame a idrogeno. Le α-eliche stabili terminano tipicamente con un aminoacido carico per neutralizzare il momento di dipolo.