
Definizione
Quando due diversi metalli o leghe sono immersi in una soluzione corrosiva o regolarmente collegati dall’umidità, ciascuno svilupperà un potenziale di corrosione. Se ci sono le condizioni per la corrosione galvanica, il metallo più nobile diventerà il catodo e il metallo più attivo diventerà l’anodo. Una corrente misurabile può fluire tra l’anodo e il catodo. Se questo accade, la velocità di corrosione dell’anodo nell’ambiente di servizio sarà aumentata mentre la velocità di corrosione del catodo diminuirà. L’aumento della corrosione dell’anodo è chiamato “corrosione galvanica”.
La corrosione galvanica è talvolta usata per estendere la vita dei materiali (ad esempio i rivestimenti di zinco su acciaio al carbonio e gli anodi di zinco negli scaldabagni), ma, se non è considerata e se esistono le condizioni giuste, può portare a guasti inaspettati.
Requisiti per la corrosione galvanica:
Perché si verifichi la corrosione galvanica, sono necessari tre elementi.
- Due metalli con diversi potenziali di corrosione
- Contatto elettrico diretto metallo-metallo
- Una soluzione elettrolitica conduttiva (ad esempio acqua) deve collegare i due metalli su base regolare. La soluzione elettrolitica crea un “percorso conduttivo”. Questo può avvenire quando c’è un’immersione regolare, condensa, pioggia, esposizione alla nebbia o altre fonti di umidità che inumidiscono e collegano i due metalli.
Se manca uno di questi elementi, la corrosione galvanica non può avvenire. Se, per esempio, il contatto diretto tra i due metalli è impedito (rondella di plastica, pellicola di vernice ecc.) o se c’è qualche altra interruzione nel percorso conduttivo, non ci può essere corrosione galvanica e ogni metallo si corroderà al suo tasso normale in quell’ambiente di servizio. La figura 1 mostra esempi di condizioni che non soddisfano tutti i requisiti per la corrosione galvanica.
Figura 1
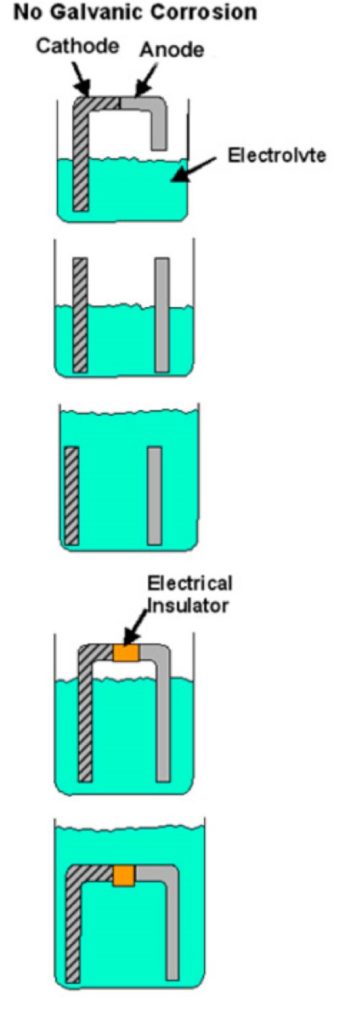
Esempi di combinazioni bi-metalliche quando la corrosione galvanica non può avvenire
Quando due metalli diversi sono accoppiati insieme in atmosfera o in acqua, la probabilità di sviluppare corrosione galvanica può essere prevista utilizzando una “serie galvanica”.” In applicazioni specializzate, come quando metalli dissimili sono incorporati nel calcestruzzo, dovrebbero essere usati i dati di corrosione per quell’ambiente specifico.
Figura 2
La figura 2 mostra la serie galvanica misurata in acqua di mare per alcuni metalli e leghe comuni. Quando due metalli sono più distanti nella lista (per esempio una maggiore differenza tra i due numeri), la forza motrice della corrosione galvanica aumenta. I metalli più anodici (attivi) sono in cima e i più catodici (nobili) in fondo. Sia le barre solide che quelle vuote sono mostrate per gli acciai inossidabili. Le barre vuote rappresentano l’acciaio inossidabile attivamente corrosivo, che ha un potenziale diverso dall’acciaio inossidabile passivo (non corrosivo). Nella maggior parte delle applicazioni, dove metalli dissimili sono combinati, la barra passiva (solida) dovrebbe essere usata per determinare la posizione dell’acciaio inossidabile.
Per esempio, se lo zinco (pensate all’acciaio galvanizzato) che è un materiale attivo e vicino alla cima della lista e l’acciaio inossidabile, un metallo nobile e vicino al fondo della lista fossero in contatto diretto e in presenza di un elettrolita (acqua), la corrosione galvanica avverrà se sono regolarmente esposti a un elettrolita.
