
Definición
Cuando dos metales o aleaciones diferentes se sumergen en una solución corrosiva o se conectan regularmente por la humedad, cada uno desarrollará un potencial de corrosión. Si se dan las condiciones para la corrosión galvánica, el metal más noble se convertirá en el cátodo y el metal más activo en el ánodo. Entre el ánodo y el cátodo puede fluir una corriente medible. Si esto ocurre, la velocidad de corrosión del ánodo en el entorno de servicio aumentará, mientras que la velocidad de corrosión del cátodo disminuirá. El aumento de la corrosión del ánodo se denomina «corrosión galvánica»
La corrosión galvánica se utiliza a veces para prolongar la vida útil de los materiales (es decir, los revestimientos de zinc en el acero al carbono y los ánodos de zinc en los calentadores de agua), pero, si no se tiene en cuenta y se dan las condiciones adecuadas, puede provocar fallos inesperados.
Requisitos para la corrosión galvánica:
Para que se produzca la corrosión galvánica, se requieren tres elementos.
- Dos metales con diferentes potenciales de corrosión
- Contacto eléctrico directo de metal a metal
- Una solución electrolítica conductora (por ejemplo, agua) debe conectar los dos metales de forma regular. La solución electrolítica crea un «camino conductor». Esto podría ocurrir cuando hay una inmersión regular, condensación, lluvia, exposición a la niebla u otras fuentes de humedad que humedecen y conectan los dos metales.
- Si falta alguno de estos elementos, la corrosión galvánica no puede ocurrir. Si, por ejemplo, se impide el contacto directo entre los dos metales (arandela de plástico, película de pintura, etc.) o si hay alguna otra interrupción en la trayectoria conductora, no puede haber corrosión galvánica y cada metal se corroerá a su ritmo normal en ese entorno de servicio. La figura 1 muestra ejemplos de condiciones que no cumplen todos los requisitos para la corrosión galvánica.
Figura 1
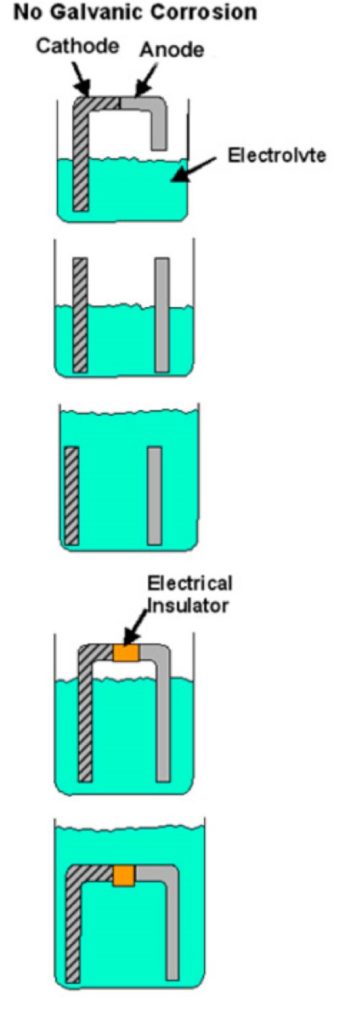
Ejemplos de combinaciones bimetálicas en las que no puede producirse corrosión galvánica
Cuando dos metales diferentes se acoplan en la atmósfera o en el agua, la probabilidad de desarrollar corrosión galvánica puede predecirse utilizando una «serie galvánica.» En aplicaciones especializadas, como cuando se incrustan metales distintos en el hormigón, deben utilizarse los datos de corrosión para ese entorno específico.
Figura 2
La figura 2 muestra la serie galvánica medida en agua de mar para algunos metales y aleaciones comunes. Cuando dos metales están más separados en la lista (por ejemplo, una mayor diferencia entre los dos números), la fuerza impulsora de la corrosión galvánica aumenta. Los metales más anódicos (activos) están en la parte superior y los más catódicos (nobles) en la inferior. Para los aceros inoxidables se muestran barras sólidas y huecas. Las barras huecas representan el acero inoxidable que se corroe activamente, que tiene un potencial diferente al del acero inoxidable pasivo (que no se corroe). En la mayoría de las aplicaciones, en las que se combinan metales distintos, la barra pasiva (sólida) debe utilizarse para determinar la posición del acero inoxidable.
Por ejemplo, si el zinc (piense en el acero galvanizado), que es un material activo y está cerca de la parte superior de la lista, y el acero inoxidable, un metal noble y cerca de la parte inferior de la lista, estuvieran en contacto directo y en presencia de un electrolito (agua), se producirá corrosión galvánica si se exponen regularmente a un electrolito.
