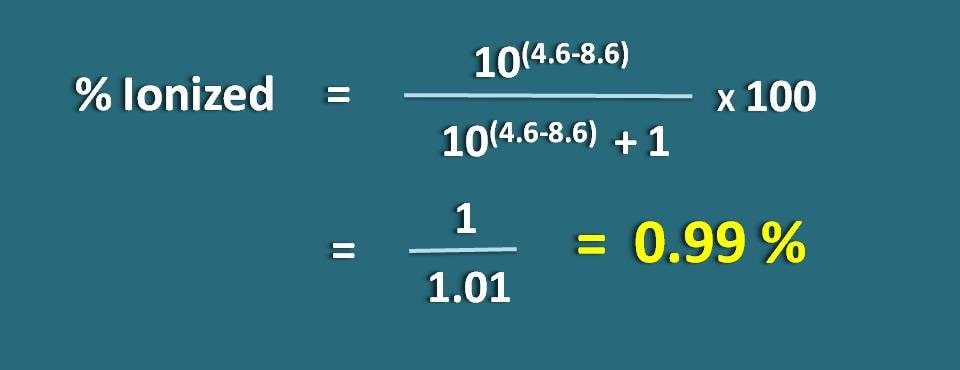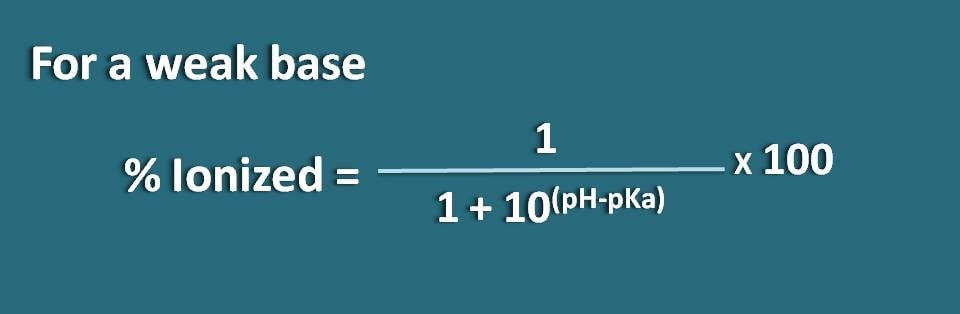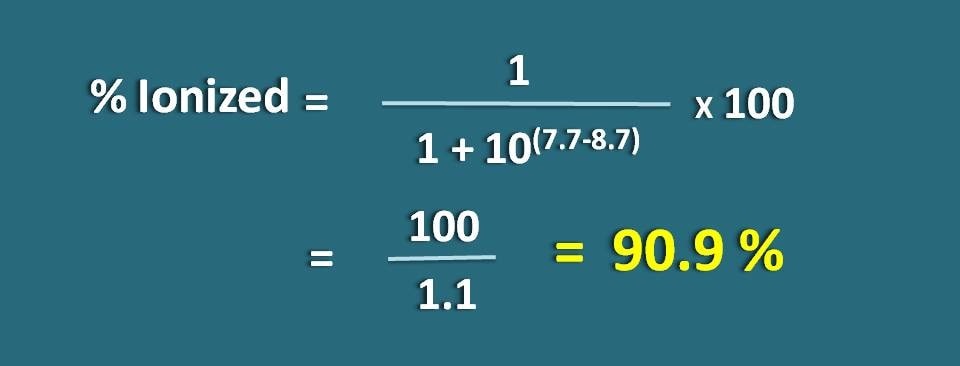Parfois, nous avons besoin de connaître l’état d’ionisation d’un composé organique afin d’évaluer quelques-unes des propriétés physico-chimiques du composé. Par exemple, si le composé est plus ionisé à un pH particulier, il aura une plus grande solubilité dans l’eau. D’autre part, si nous nous concentrons sur la perméabilité du composé à travers une membrane physiologique, alors la forme ionisée du composé est plus importante car elle sera plus lipophile et pourra traverser la membrane lipophile.
Donc, le calcul du pourcentage d’ionisation est une tâche essentielle que nous rencontrons de nombreuses fois lorsque nous traitons de la pharmacocinétique des médicaments. Voyons ici comment nous pouvons le calculer accompagné de quelques exemples.
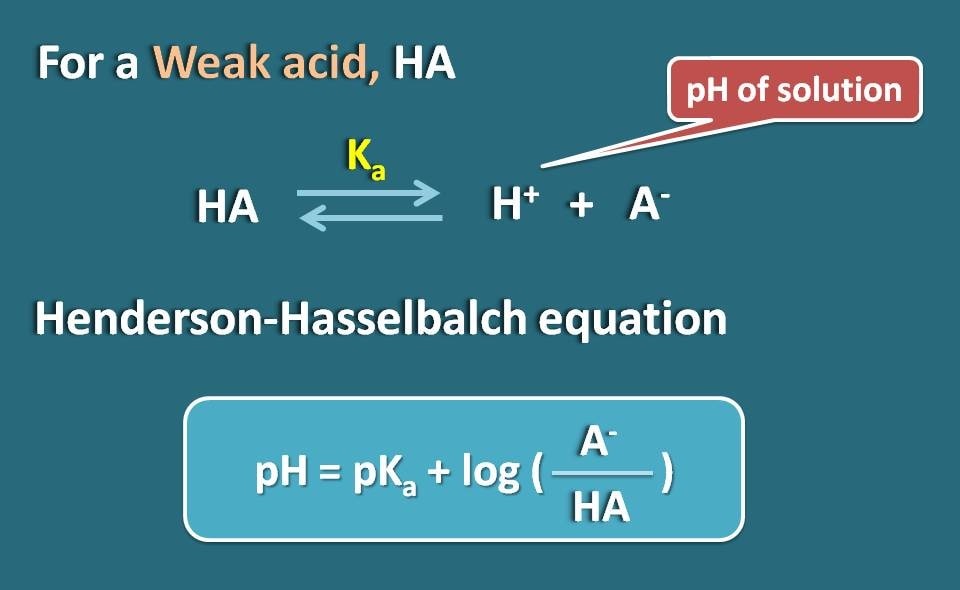
Equation de Henderson-Hasselbalch
Prenons un électrolyte faible tel que l’HA qui agit comme un acide faible. Lorsqu’il se dissout dans l’eau, il n’est pas complètement ionisé mais atteint l’équilibre de sorte qu’il peut exister aussi bien sous forme ionisée que sous forme unionisée.
En appliquant l’équation de Hendersen-Hasselbach pour l’acide faible, nous pouvons relier le pH de la solution avec le pKa du médicament et son ionisation.
Donc, pH=pKa + log(A-/HA)
Où A- est la forme ionisée de l’acide faible alors que HA est la forme unionisée.
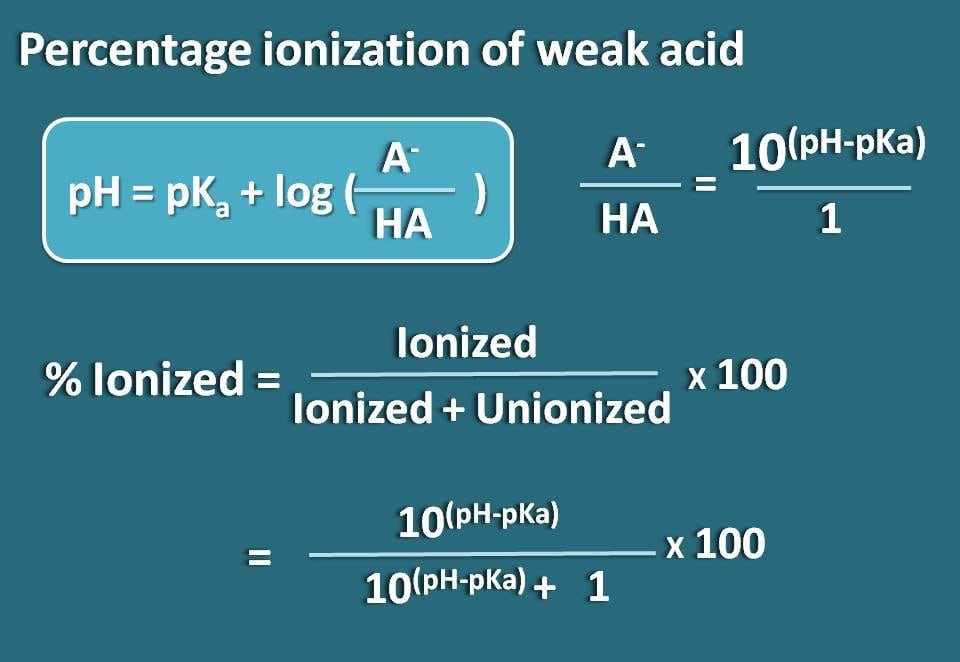
Maintenant, réarrangeons cette équation de façon à obtenir le rapport entre les formes ionisées et unionisées de l’acide faible.
log(A-/HA)=pH – pKa
En prenant l’antilogarithme,
A-/HA=10(pH – pKa)
Nous connaissons maintenant le rapport entre la forme ionisée et la forme unionisée. A partir de là, nous pouvons calculer le pourcentage d’ionisation.
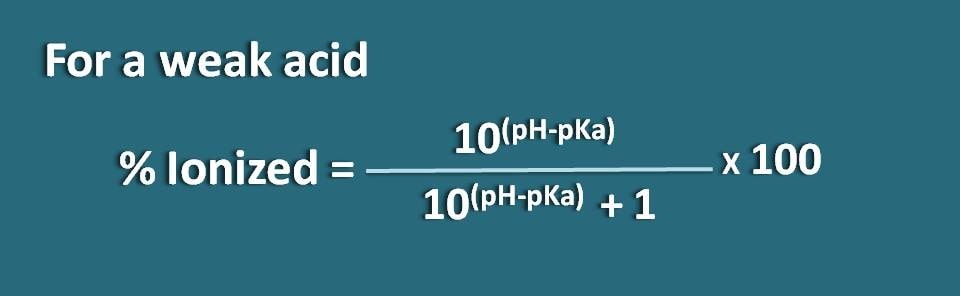
% ionisé= * 100
Substituer dans cette équation,
% ionisé=* 100
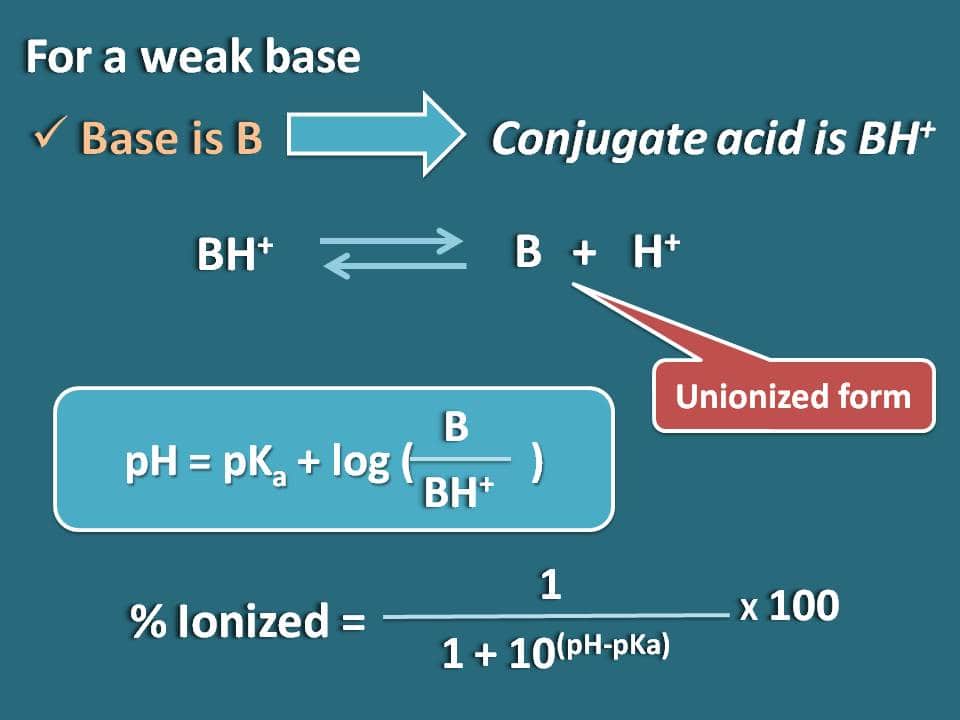
De la même manière, nous pouvons obtenir la formule pour une base faible comme B dont l’acide conjugué est BH+. Maintenant, nous pouvons écrire l’équilibre chimique pour l’acide conjugué comme ci-dessous.
Ecrivons maintenant l’équation de Hendersen-Hasselbalch pour l’acide conjugué
pH=pKa + log (B/BH+)
Maintenant, le rapport entre les formes unionisées et ionisées de la base peut être écrit comme
B/BH+=10(pH – pKa)
Ici, la portion de forme unionisée est de 10(pH – pKa) alors que la forme ionisée est de 1. Donc le pourcentage d’ionisation sera
% ionisé=* 100
Alternativement, nous pouvons également réarranger l’équation ci-dessus en inversant le terme pH-pKa en pKa-pH où nous obtenons la formule comme
Maintenant, allons avec quelques-uns des exemples pratiques et voyons comment nous pouvons les résoudre.
Exemple pratique 1
Calculez le pourcentage ionisé d’un médicament faiblement acide à un pH de 4,6 avec une valeur pKa égale à 8,6.
Solution:
Enumérons d’abord les données fournies.
PH=4,6 et pKa=8,6
Puisqu’il s’agit d’un médicament faiblement acide, appliquons la formule suivante.
Substituer dans l’équation ci-dessus,
% ionisé=* 100
=1/1,01=0.99 %
Voyons un autre exemple.
Exemple de travail 2
Calculer la fraction de médicament sous forme ionisée à pH 7.7 d’un tissu pour un médicament basique dont le pKa est de 8,7.
Solution:
En premier lieu, énumérons les données fournies.
PH=7.7 et pKa=8,7
Il s’agit ici d’une base faible, nous devons donc appliquer la formule suivante.
Substituer dans l’équation ci-dessus,
% ionisé=* 100
=100/1.1=90,9 %
Enfin, nous concluons avec un autre exemple.
Exemple de travail 3
Calculez le rapport entre les formes protonées et non protonées de la morphine à pH 5. Le pKa de la morphine est de 7.
Solution:
De nouveau, la date donnée est pH=5 et pKa=7.
La morphine est un analgésique opioïde qui a une amine tertiaire dans le cycle donc agit comme une base faible. Mais ici on a demandé le rapport entre les formes protonées et non protonées du médicament. La forme protonée n’est rien d’autre que la forme ionisée tandis que la forme non protonée est la forme unie. Pour une base faible, le rapport sera de 10(pH – pKa) : 1 .
et substituons les valeurs.
Protonée/non protonée=10(5 – 7)/1
.