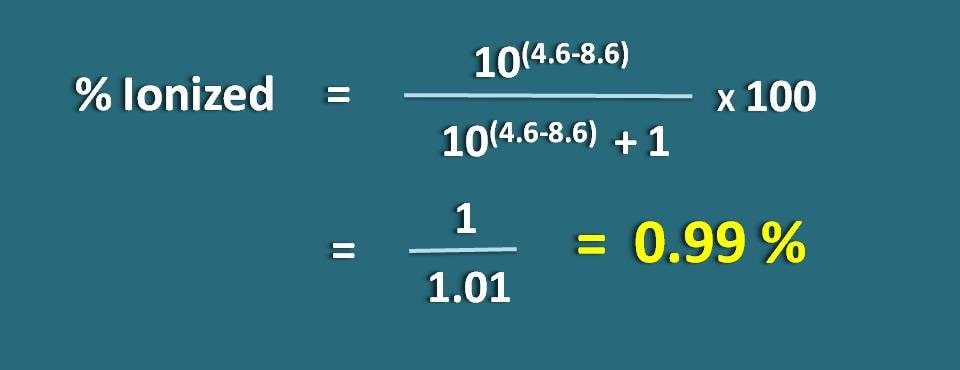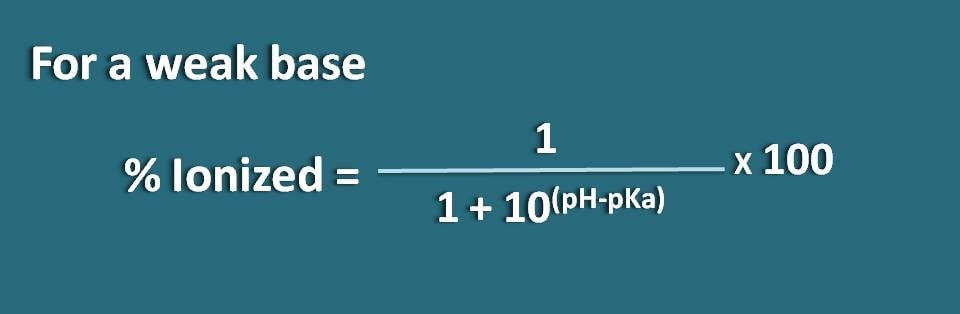Por vezes precisamos de saber o estado de ionização de um composto orgânico a fim de avaliar poucas das propriedades físico-químicas do composto. Por exemplo, se o composto for mais ionizado a um determinado pH, terá mais solubilidade na água. Por outro lado, se nos concentrarmos na permeabilidade do composto através de uma membrana fisiológica, então a forma de união do composto é mais importante, pois será mais lipofílica e pode atravessar a membrana lipofílica.
Assim, o cálculo da percentagem de ionização é uma tarefa essencial com que nos deparamos muitas vezes enquanto lidamos com a farmacocinética dos medicamentos. Vejamos aqui como o podemos calcular juntamente com poucos exemplos.
Henderson-Hasselbalch equação
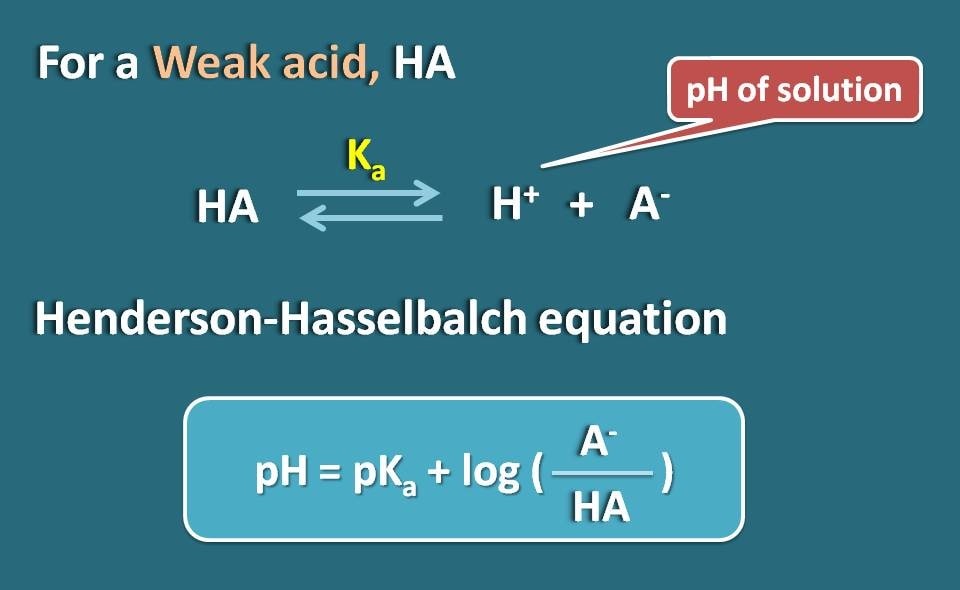
P>Letremos um electrólito fraco como o HA que actua como ácido fraco. Quando dissolvido na água, não é completamente ionizado, mas atinge o equilíbrio para que possa existir tanto em formas ionizadas como unionizadas.

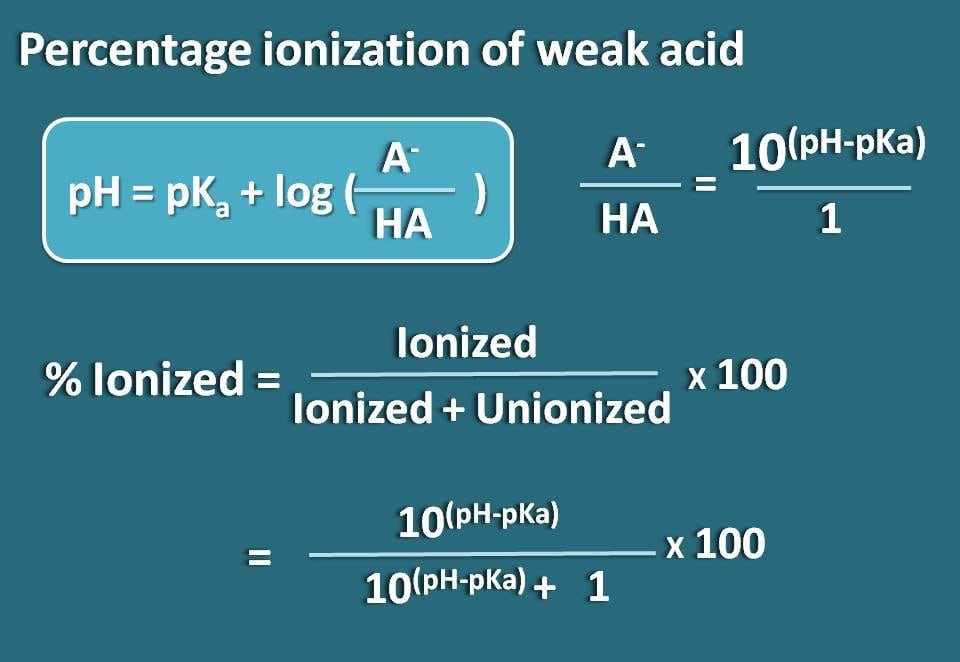
Assim, pH=pKa + log(A-/HA)
Onde A- é a forma ionizada do ácido fraco enquanto HA é a forma de união.
Agora vamos reorganizar esta equação de modo a obter a razão entre as formas ionizadas e sindicalizadas do ácido fraco.
log(A-/HA)=pH – pKa
Taking antilogarithm,
A-/HA=10(pH – pKa)
P>Agora, sabemos a razão entre a forma ionizada e a forma unionizada. A partir disto podemos calcular a percentagem de ionização.
% ionizada= * 100
Subsituação nesta equação,
% ionizada=* 100
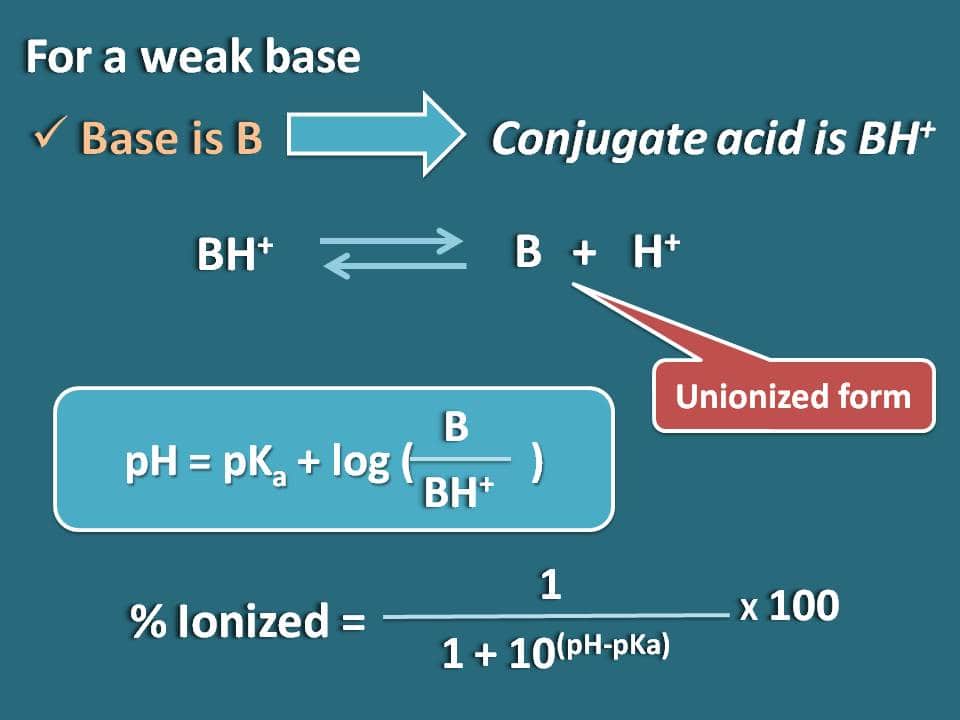
Simplesmente podemos obter a fórmula para uma base fraca como B cujo ácido conjugado é BH+. Agora podemos escrever o equilíbrio químico para o ácido conjugado como abaixo.
Agora escrevendo a equação de Hendersen-Hasselbalch para o ácido conjugado
p>pH=pKa + log (B/BH+)
Agora a razão entre as formas de união e ionizadas da base pode ser escrita como
B/BH+=10(pH – pKa)
Aqui a parte da forma de união é 10(pH – pKa) enquanto que a forma ionizada é 1. Assim, a percentagem de ionização será
% ionizada=* 100
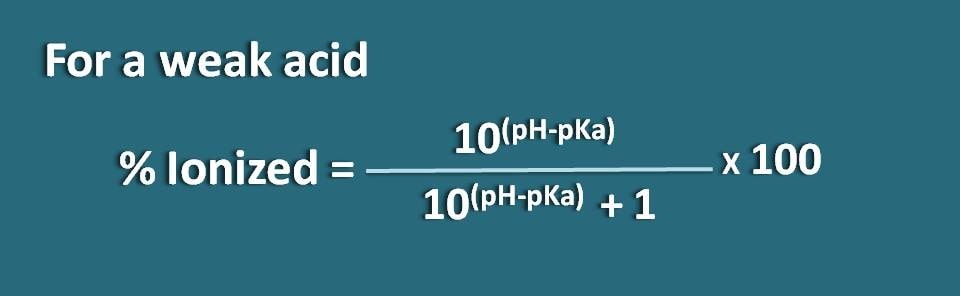
Alternativamente, também podemos reorganizar a equação acima invertendo o termo pH-pKa em pKa-pH onde obtemos a fórmula como
% ionizado=* 100

Agora vamos com alguns dos exemplos práticos e vamos ver como podemos resolvê-los.
Exemplo de trabalho 1
Calcular a percentagem ionizada de uma droga fracamente ácida a um pH de 4,6 com valor pKa de 8,6.
Solução:
P>Primeiro dos dados fornecidos.
p>pH=4,6 e pKa=8,6
P>Por ser uma droga fracamente ácida, vamos aplicar a seguinte fórmula.
Substituindo na equação acima,
% ionizado=* 100
=1/1,01=0.99 %
Vamos com outro exemplo,
Exemplo de trabalho 2
Calcular a fracção de fármaco na forma ionizada a pH 7.7 de um tecido para um medicamento básico com pKa 8.7.
Solução:
P>Primeiro dos dados fornecidos.
p>pH=7.7 e pKa=8.7
Aqui é uma base fraca, por isso temos de aplicar a seguinte fórmula.
Substituindo na equação acima,
% ionizado=* 100
=100/1.1=90,9 %
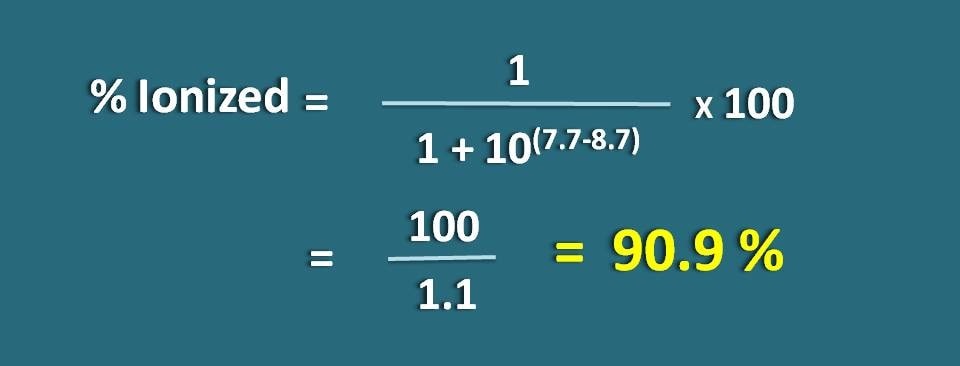
Finalmente, concluímos com um exemplo diferente.
Exemplo de trabalho 3
Calcular a razão entre as formas protonadas e não-protonadas de morfina a pH 5. pKa de morfina é 7,
Solução:
Ganhar a data dada é pH=5 e pKa=7,
Morfina é um analgésico opiáceo que tem amina terciária no anel, portanto age como uma base fraca. Mas aqui foi perguntado o rácio entre as formas protonadas e não-protonadas da droga. A forma protonada não é mais do que a forma ionizada enquanto que a forma não protonada é a forma sindicalizada. Para uma base fraca, a razão será 10(pH – pKa) : 1 .
e vamos substituir os valores.
Protonado/ não-protonado=10(5 – 7)/1