Le greffage, technique agronomique ancienne, est un type de multiplication végétative/asexuelle des plantes. Il est généralement réalisé en exploitant la croissance de cals après une blessure de la plante. Le greffage est encore une technique courante dans le domaine du jardinage. Le greffage est utilisé en agriculture depuis > 2 000 ans avant notre ère (avant l’ère commune) en Chine. Elle est largement utilisée en agriculture, et dans la culture des arbres forestiers, et des plantes horticoles. Par exemple, les cultivars présentant une résistance aux agents pathogènes ou une tolérance au stress sont généralement utilisés comme porte-greffes pour améliorer la vigueur de croissance des cultivars aériens à forte valeur économique. Le greffage a également été utilisé pour briser le stade juvénile afin de promouvoir la floraison chez les espèces ligneuses. Par rapport aux cultures génétiquement modifiées, les plantes greffées sont plus agréables au goût du public. Le greffage est également une technique utile dans la recherche scientifique sur les plantes. Des efforts considérables ont été déployés dans ce sens dans les années 70 et 80 du siècle dernier. Cependant, avec le développement rapide de la biotechnologie, la recherche sur le greffage s’est progressivement déplacée de l’amélioration des caractéristiques agronomiques vers l’étude du mécanisme moléculaire. Des études ont démontré que le greffage est un excellent outil pour élucider les mécanismes impliqués dans les processus de signalisation à longue portée au sein des plantes, tels que ceux impliqués dans la floraison , la régulation de l’auxine , la tolérance aux métaux lourds , le mouvement des petits ARN , l’état nutritionnel et le silençage nucléaire .
Il est bien connu que les facteurs affectant les taux de survie des greffons dépendent principalement de la compatibilité du porte-greffe et du scion. La compatibilité fait référence à la similitude entre le porte-greffe et le scion en ce qui concerne les caractéristiques structurelles, génétiques et physiologiques, et la capacité à s’adapter l’un à l’autre après la greffe. La compatibilité des greffes provenant des mêmes plantes est la plus forte ; plus la relation entre les plantes est éloignée, plus la compatibilité entre elles est faible. Il est difficile de greffer des plantes de genres différents. Outre la compatibilité des scions et des porte-greffes, la vigueur du porte-greffe et du scion est également un facteur important qui affecte la survie des greffes. Le taux de survie des plantes greffées varie également selon les espèces, et le taux de survie du corps greffé est différent même chez la même espèce à différents âges. De plus, les facteurs environnementaux tels que la température, l’humidité et l’intensité lumineuse peuvent également affecter le taux de survie des plantes greffées. En conclusion, il existe de nombreux facteurs qui influencent le taux de survie des greffons.
Arabidopsis thaliana et Eutrema salsugineum (Thellungiella salsuginea) appartiennent à la même famille Cruciferae mais à des genres différents. Arabidopsis thaliana est utilisée comme plante modèle dans les études génétiques des plantes dicotylédones. Eutrema Salsugineum (alias cresson de mer) est une excellente plante tolérante au sel, et le génome d’E. salsugineum a été complété. Environ 95% des gènes d’E. salsugineum sont similaires à ceux exprimés dans Arabidopsis, et la plupart des séquences d’acides aminés sont les mêmes que celles d’Arabidopsis. Eutrema salsugineum a un génome nucléaire relativement petit, environ deux fois celui d’A. thaliana. Tous les écotypes d’E. salsugineum présentent une résistance à une série de stress environnementaux tels que le froid, la sécheresse et les stress oxydatifs. E. salsugineum a attiré l’attention en raison de son extrême tolérance au sel. Il y a plus de 20 ans, le cresson de fontaine a été proposé comme modèle d’halophyte pour l’étude de la tolérance au sel. Cela a ouvert une nouvelle fenêtre pour la recherche couvrant un large éventail d’aspects, y compris non seulement le stress abiotique, mais aussi la photosynthèse, la fonction des protéines liées au stress et la production de cire de surface en utilisant E. salsugineum comme plante modèle. Chez Arabidopsis, plusieurs approches de greffage ont été développées pour étudier la signalisation systémique. Cependant, à notre connaissance, il n’existe aucun rapport sur les méthodes de greffage pour E. salsugineum, ou sur les méthodes de greffage entre Arabidopsis et Eutrema. La difficulté de la greffe entre ces plantes est significativement élevée. La réussite du greffage de ces deux plantes modèles contribuera à fournir des informations cruciales sur les mécanismes moléculaires qui sous-tendent la tolérance des plantes au stress. Nous démontrons ici deux méthodes de micro-greffe stérile pour la greffe inter-générique entre Arabidopsis et Eutrema, avec les avantages de la simplicité et du taux de survie élevé.
Méthodes de greffe
Dans la présente étude, nous nous concentrons sur deux protocoles efficaces de micro-greffe de semis stériles entre Arabidopsis, une plante sensible au sel, et le cresson de mer, une plante tolérante au sel. La première méthode consistait à couper les semis à plat, hypocotyle-hypocotyle, comme décrit par Seung et Turnbull et al. avec quelques modifications. L’autre méthode était le greffage par coupe, que nous allons démontrer ici. L’abréviation A/E utilisée ici indique que les scions de A. thaliana ont été greffés sur des souches de E. salsugineum, et inversement E/A indique que les scions de E. salsugineum ont été greffés sur des souches de A. thaliana. Dans une expérience témoin, l’autogreffe de A. thaliana et E. salsugineum a été effectuée. Les semis autogreffés de A. thaliana sont désignés par A/A et les semis autogreffés de E. salsugineum sont désignés par E/E. Des méthodes de greffage optimisées ont été appliquées à différents porte-greffes et scions. La méthode de greffage par coupe a été utilisée pour A/E (Fig. 1a) et l’autre méthode, c’est-à-dire la coupe à plat hypocotyle-hypocotyle, a été utilisée pour A/A, E/E et E/A (Fig. 1c, d). Il est relativement facile de réussir une greffe en utilisant la méthode de greffage conventionnelle (c’est-à-dire la coupe à plat de l’hypocotyle et de l’hypocotyle), et la croissance ultérieure des plantes greffées est généralement satisfaisante. Par conséquent, nous ne discuterons pas de cette méthode dans le présent document.

Diagramme de la technique de greffage. a, b Deux méthodes différentes de greffage d’Arabidopsis thaliana greffé sur Eutrema. Salsugineum (A/E), greffage par bouturage (a) et bouturage hypocotyle-hypocotyle à surface plane (b). c E/A (E. salsugineum comme scions ont été greffés sur A. thaliana comme souches. (d) Autogreffage de E. salsugineum (E/E) et A. thaliana (A/A). La ligne rouge indique la position de coupe. Les pointes de flèches orange indiquent la jonction de greffage entre la pousse et le tissu racinaire avec un support en tuyau de silicone (gris clair). Les flèches rouges dans (a) indiquent les parties à couper ou à enlever. Les différences de couleur indiquent des plantes différentes, en bleu pour E. salsugineum et en vert pour A. thaliana. Les racines ne sont pas montrées ici
Matériaux et conditions de croissance
Les graines d’Arabidopsis thaliana Columbia-0 (Col) et les graines d’E. salsugineum (Shandong, Chine) utilisées dans cette étude sont conservées et propagées dans notre laboratoire. Les plantes ont été cultivées dans des conditions de lumière de jour long (LD 16/8 h lumière/obscurité) ou de jour court (SD 8/16 h lumière/obscurité), avec des cycles jour/nuit de 22 °C/18 °C et une intensité lumineuse de 100 μmol m-2s-1.
Procédure de greffage
Le protocole étape par étape de la méthode de greffage par coupe appliquée pour A/E était le suivant :
Préparation des matériaux du porte-greffe et du scion : les graines de cresson salé ont été désinfectées avec 0.5 % NaClO (chlorhydrate de sodium) pendant 6 min, suivie de 4 à 5 rinçages dans de l’eau distillée, puis semées en conditions stériles sur un milieu Murashige et Skoog (MS) demi-puissant contenant 1,0 % d’agar et 1 % de sucre. Une semaine après le traitement de stratification à basse température (4 °C), les semis ont été transférés en conditions SD et cultivés verticalement à la lumière pendant 10-15 jours (ou 7-10 jours après la germination) comme des semis de porte-greffe. Pour la germination des graines d’Arabidopsis, la méthode de stérilisation et les conditions de croissance étaient les mêmes que celles d’E. salsugineum, à l’exception du traitement de stratification à basse température (4 °C), qui a duré 2-3 jours. L’âge optimal pour le greffage des plantules d’Arabidopsis est de 3 à 5 jours. Comme le temps de germination et le taux de croissance des deux espèces sont différents, les temps de plantation ont été ajustés en conséquence. Habituellement, Arabidopsis devrait être planté après la germination des graines de cresson salé.
-
Greffage dans des conditions stériles (Fig. 1a) : La procédure de greffage a été effectuée sous des microscopes anatomiques dans une hotte stérile. Les plantules d’E. salsugineum de taille uniforme ont été déplacées à l’aide de pinces sur un nouveau milieu MS agar à moitié fort à 1,0%. Pour être utilisés comme porte-greffe, les vraies feuilles et les méristèmes ont été enlevés des plantules de cresson de fontaine à l’aide d’un rasoir en acier inoxydable à lame à double tranchant, tandis que les cotylédons ont été conservés. Dans les mêmes conditions stériles, l’hypocotyle des semis d’A. thaliana a été coupé transversalement à environ un quart de la hauteur à partir du sommet (généralement 2-3 mm) et la partie supérieure du semis a été utilisée comme scion. Le bouturage de A. thaliana comme scion peut être effectué directement dans les plaques de milieu d’origine ou dans les plaques où le cresson alpestre a été préparé comme porte-greffe. Le scion d’A. thaliana a été greffé sur le cresson salé sans aucune fixation car la petite quantité de liquide sur les surfaces de coupe des deux parties est suffisante pour les maintenir ensemble. Ensuite, la boîte de Pétri a été rapidement mais soigneusement scellée avec du parafilm pour préserver l’humidité. Veuillez prendre soin de vous assurer que les feuilles sont naturellement étendues pour éviter un éventuel délogement dû à la croissance de la plante.
-
Culture du corps greffé : Le complexe A/E greffé a été placé en conditions SD dans une armoire de croissance Percival pendant 6 à 8 jours.
-
Transplantation des plantules greffées (Fig. 2) : Six à huit jours après la greffe, l’interface de l’aboutement a été examinée au microscope anatomique. À ce moment-là, la greffe réussie devrait avoir une connexion solide entre le scion et la souche. Les plantules ont ensuite été transférées dans un système hydroponique ou un sol nutritif selon les besoins. Après la transplantation, il faut faire attention à couper les racines adventives à temps, si celles-ci apparaissent.
Fig. 2 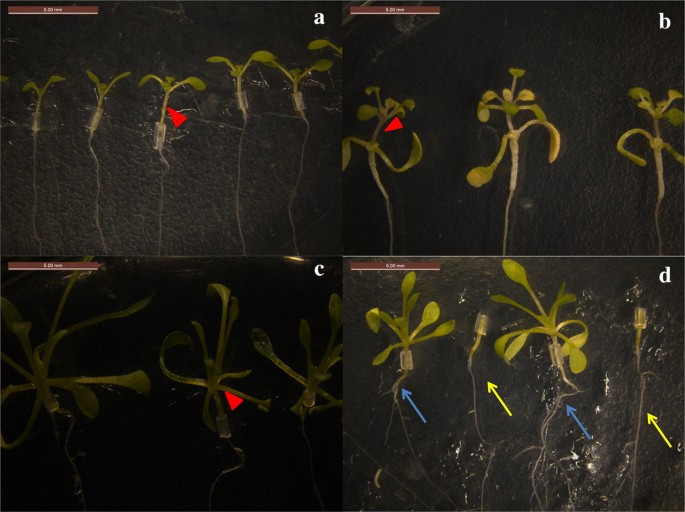
Succès des semis greffés. a Autogreffage de A. thaliana (A/A). b Semis greffés A/E. c Autogreffage de E. salsugineum (E/E). d Semis greffés E/A. Les flèches rouges en a-c indiquent les sites de greffage. Les racines d’Arabidopsis thaliana comme porte-greffe sont représentées par des flèches de différentes couleurs dans d, les flèches bleues indiquent les racines après la greffe, et les flèches jaunes indiquent les racines avant le greffage
Désinfection de la surface des graines
Dans la méthode de greffage à l’emporte-pièce, la surface des graines a été désinfectée directement en utilisant 0.5% de chlorhydrate de sodium (NaClO) pendant 6-8 min, puis lavée à l’eau stérile pendant 4-6 fois. Cette méthode permet d’éviter l’utilisation d’alcool pour la stérilisation. De plus, la méthode de stérilisation au NaClO est simple, ce qui réduit la pollution secondaire, et les graines peuvent germer normalement. Elle évite également la non-germination des graines en raison d’une stérilisation excessive, qui affecte la germination des graines et les analyses ultérieures. Tant que la concentration de NaClO est contrôlée correctement, une sur-stérilisation ne se produira pas même si la stérilisation dure plusieurs minutes.
Age des plantules
Dans la méthode de greffage par bouturage, des plantules d’E. salsugineum (7-10 jours après la germination) avec des racines latérales, peuvent mieux répondre aux caractéristiques de croissance rapide de leurs scions (A. thaliana), cela réduit également la formation de racines adventives, améliore considérablement le taux de survie des greffes et assure la croissance vigoureuse des semis greffés au stade ultérieur (tableau 1). Nous avons constaté que les semis d’Arabidopsis âgés de 3 à 5 jours étaient favorables à l’amélioration du taux de survie des semis greffés ; cela favorise également la croissance vigoureuse des semis greffés (Tableau 1). Cela peut être dû au fait que le cycle de vie d’A. thaliana est court, comparé à celui d’E. salsugineum. Par conséquent, l’utilisation de plantules A. thaliana plus âgées comme scions a entraîné de faibles taux de survie ; même si les greffes A/E ont survécu, la croissance aux stades ultérieurs était faible et une floraison précoce est généralement observée.
Méthode de coupe à surface plane
Plusieurs types de méthodes de greffage ont été rapportés pour A. thaliana . Dans la présente étude, la méthode de greffage par coupe n’a été utilisée que pour les greffes A/E et la méthode de coupe à surface plane hypocotyle-hypocotyle a été utilisée pour A/A, E/E et E/A (Fig. 1c, d). Les deux méthodes requièrent les mêmes conditions de culture, à l’exception du site de coupe. Des plantules âgées de 3 à 5 jours ont été utilisées pour l’auto-greffage A/A. Pour le greffage E/A, des plantules de 7 à 10 jours de A. thaliana comme porte-greffe sont plus bénéfiques pour la survie des greffons. De même, des plantules âgées de 7 à 10 jours ont été utilisées pour l’auto-greffage E/E. Nous avons constaté que le taux de survie et la croissance ultérieure des plantules A/E étaient significativement différents entre les deux méthodes de greffage (Fig. 1a, b et Tableau 2). La méthode d’insertion est plus satisfaisante pour le greffage A/E. La raison principale pourrait être la croissance rapide des plants. La raison principale pourrait être que le taux de croissance rapide d’A. thaliana s’adapte mieux à cette méthode. Lorsque la coupe traditionnelle à surface plane a été utilisée pour la greffe A/E, les racines adventives du scion apparaissent avant la formation du cal à la jonction, ce qui affecte le taux de réussite des plantes greffées, car la croissance du cresson salé est plus lente que celle d’A. thaliana. En comparaison, le taux de réussite de la méthode du bouturage est presque de 100% tant que la coupe est lisse et les deux parties bien placées.
.
