Szczepienie, stara technika agronomiczna, jest rodzajem wegetatywnego/płciowego rozmnażania roślin. Zazwyczaj przeprowadza się ją poprzez wykorzystanie wzrostu kalusa po uszkodzeniu rośliny. Szczepienie jest nadal powszechnie stosowaną techniką w ogrodnictwie. Szczepienie jest stosowane w rolnictwie od > 2 000 lat BCE (przed erą powszechną) w Chinach. Jest ono szeroko stosowane w rolnictwie, uprawie drzew leśnych i roślin ogrodniczych. Na przykład odmiany o odporności na patogeny lub tolerancji na stres są zwykle wykorzystywane jako podkładki w celu poprawy wigoru wzrostu nadziemnych odmian o wysokiej wartości ekonomicznej. Szczepienie było także stosowane do przerywania stadium młodocianego w celu promowania kwitnienia u gatunków drzewiastych. W porównaniu z uprawami modyfikowanymi genetycznie, rośliny szczepione są bardziej przyjazne dla społeczeństwa. Szczepienie jest również użyteczną techniką w badaniach naukowych nad roślinami. Znaczne wysiłki w tym kierunku podjęto w latach 70-tych i 80-tych ubiegłego wieku. Jednakże, wraz z szybkim rozwojem biotechnologii, nacisk na badania nad szczepieniem stopniowo przesunął się z poprawy cech agronomicznych na badania nad mechanizmami molekularnymi. Badania wykazały, że szczepienie jest doskonałym narzędziem do wyjaśnienia mechanizmów zaangażowanych w procesy sygnalizacyjne o dużym zasięgu w obrębie roślin, takie jak te związane z kwitnieniem, regulacją auksyny, tolerancją na metale ciężkie, przemieszczaniem małego RNA, stanem odżywienia i wyciszaniem jądrowym .
Powszechnie wiadomo, że czynniki wpływające na przeżywalność szczepów zależą głównie od zgodności podkładki i zraza. Zgodność odnosi się do podobieństwa między podkładką i zrazem w odniesieniu do cech strukturalnych, genetycznych i fizjologicznych oraz zdolności do wzajemnego przystosowania się po szczepieniu. Zgodność szczepów pochodzących z tych samych roślin jest najsilniejsza; im dalsze pokrewieństwo między roślinami, tym słabsza zgodność między nimi. Trudno jest szczepić rośliny z różnych rodzajów. Poza zgodnością zrazów i podkładek, ważnym czynnikiem wpływającym na przeżywalność szczepów jest także wigor podkładki i zraza. Wskaźnik przeżywalności szczepionych roślin różni się także w zależności od gatunku, a wskaźnik przeżywalności szczepu jest różny nawet u tego samego gatunku w różnym wieku. Ponadto czynniki środowiskowe, takie jak temperatura, wilgotność i natężenie światła, mogą również wpływać na wskaźnik przeżywalności szczepionych roślin. Podsumowując, istnieje wiele czynników, które wpływają na przeżywalność szczepów.
Arabidopsis thaliana i Eutrema salsugineum (Thellungiella salsuginea) należą do tej samej rodziny Cruciferae, ale różnych rodzajów. Arabidopsis thaliana jest wykorzystywana jako roślina modelowa w badaniach genetycznych roślin dwuliściennych. Eutrema Salsugineum (aka. Rzeżucha solna) jest doskonałą rośliną tolerującą sól, a genom E. salsugineum został skompletowany. Około 95% genów w E. salsugineum jest podobnych do tych wyrażanych w Arabidopsis, a większość sekwencji aminokwasów jest taka sama jak w Arabidopsis. Eutrema salsugineum ma stosunkowo mały genom jądrowy, około dwa razy mniejszy niż A. thaliana. Wszystkie ekotypy E. salsugineum wykazują odporność na szereg stresów środowiskowych, takich jak zimno, susza i stresy oksydacyjne. E. salsugineum zyskał uwagę dzięki swojej ekstremalnej tolerancji na sól. Dlatego już ponad 20 lat temu rzeżucha solna została zaproponowana jako modelowy halofit do badania tolerancji na sól. Otworzyło to nowe okno dla badań obejmujących szeroki zakres aspektów, w tym nie tylko stres abiotyczny, ale także fotosyntezę, funkcje białek związanych ze stresem oraz produkcję wosków powierzchniowych z wykorzystaniem E. salsugineum jako rośliny modelowej. W Arabidopsis, kilka metod szczepienia zostało opracowanych w celu zbadania sygnalizacji systemowej. Jednakże, zgodnie z naszą najlepszą wiedzą, nie ma doniesień na temat metod szczepienia E. salsugineum, lub metod szczepienia pomiędzy Arabidopsis i Eutrema. Trudność szczepienia pomiędzy tymi roślinami jest znacząco wysoka. Pomyślne zaszczepienie tych dwóch roślin modelowych pozwoli na uzyskanie istotnych informacji na temat molekularnych mechanizmów leżących u podstaw tolerancji roślin na stres. Tutaj demonstrujemy dwie sterylne metody mikrorozmnażania dla międzyrodzajowego szczepienia pomiędzy Arabidopsis i Eutrema, z zaletami prostoty i wysokiego wskaźnika przeżywalności.
Metody szczepienia
W niniejszym badaniu skupiamy się na dwóch wydajnych protokołach mikrorozmnażania sterylnych siewek pomiędzy Arabidopsis, rośliną wrażliwą na sól, i rzeżuchą solną, rośliną tolerującą sól. Jedną z metod było płaskie cięcie sadzonek na powierzchni hipokotyl-hipokotyl, jak opisali Seung i Turnbull et al. z pewnymi modyfikacjami. Drugą metodą było szczepienie metodą cut-in, którą zademonstrujemy w niniejszym opracowaniu. Używany tu skrót A/E oznacza, że zrazy A. thaliana zostały zaszczepione na sadzonkach E. salsugineum i odwrotnie E/A oznacza, że zrazy E. salsugineum zostały zaszczepione na sadzonkach A. thaliana. W doświadczeniu kontrolnym przeprowadzono samozaszczepianie A. thaliana i E. salsugineum. Sadzonki samozaszczepione A. thaliana określono jako A/A, a siewki samozaszczepione E. salsugineum jako E/E. Zoptymalizowane metody szczepienia zastosowano do różnych podkładek i zrazów. W przypadku A/E zastosowano metodę szczepienia przez wcinanie (rys. 1a), a w przypadku A/A, E/E i E/A – metodę szczepienia przez cięcie płasko-powierzchniowe hipokotyl-hipokotyl (rys. 1c, d). Stosunkowo łatwo jest uzyskać udane szczepienie przy użyciu konwencjonalnej metody szczepienia (tj. płaskie cięcie hipokotylowo-hipokotylowe), a późniejszy wzrost szczepionych roślin jest zwykle zadowalający. Dlatego nie będziemy omawiać tej metody w niniejszym dokumencie.

Diagram techniki szczepienia. a, b Dwie różne metody szczepienia Arabidopsis thaliana szczepionej na Eutrema. Salsugineum (A/E), szczepienie przez wcinanie (a) i cięcie płaskie hipokotyl-hipokotyl (b). c E/A (E. salsugineum jako zrazy szczepiono na A. thaliana jako podkładki. (d) Samozaszczepianie E. salsugineum (E/E) i A. thaliana (A/A). Czerwona linia wskazuje miejsce cięcia. Pomarańczowe strzałki wskazują miejsce szczepienia pomiędzy pędem i tkanką korzeniową z silikonową rurką podtrzymującą (jasnoszara). Czerwone strzałki w (a) oznaczają części cięcia lub usuwania. Różnice w kolorach wskazują na różne rośliny, niebieski dla E. salsugineum i zielony dla A. thaliana. Korzenie nie są tu pokazane
Materiały i warunki wzrostu
Nasiona Arabidopsis thaliana Columbia-0 (Col) i nasiona E. salsugineum (Shandong, Chiny) użyte w tym badaniu są zachowane i rozmnażane w naszym laboratorium. Rośliny uprawiano w warunkach światła długo- (LD 16/8 h światło/ciemność) lub krótko- (SD 8/16 h światło/ciemność), w cyklach dzień/noc 22°C/18°C i intensywności światła 100 μmol m-2s-1.
Procedura szczepienia
Protokół krok po kroku metody szczepienia metodą cut-in zastosowanej dla A/E był następujący:
Przygotowanie podkładki i materiałów zrazowych: nasiona rzeżuchy słonej zdezynfekowano 0.5% NaClO (wodorochloryn sodu) przez 6 min, a następnie 4-5 płukań w wodzie destylowanej, po czym wysiewano w sterylnych warunkach na pożywkę Murashige i Skoog (MS) o połowie mocy, zawierającą 1,0% agaru i 1% cukru. Tydzień po zabiegu stratyfikacji w niskiej temperaturze (4°C), siewki przenoszono do warunków SD i hodowano pionowo z dostępem światła przez 10-15 dni (lub 7-10 dni po kiełkowaniu) jako siewki podkładkowe. W przypadku kiełkowania nasion Arabidopsis, metoda sterylizacji i warunki wzrostu były takie same jak dla E. salsugineum, z wyjątkiem traktowania ich w niskiej temperaturze (4°C), które trwało 2-3 dni. Optymalny wiek do szczepienia siewek Arabidopsis wynosi 3-5 dni. Ponieważ czas kiełkowania i tempo wzrostu tych dwóch gatunków są różne, czas sadzenia został odpowiednio dostosowany. Zwykle Arabidopsis powinien być sadzony po wykiełkowaniu nasion rzeżuchy solnej.
-
Szczepienie w warunkach sterylnych (Rys. 1a): Zabieg szczepienia przeprowadzono pod mikroskopami anatomicznymi w sterylnym kapturze. Sadzonki E. salsugineum o jednakowej wielkości przenoszono za pomocą pęsety na nowe podłoże agarowe MS agar 1,0% o połowie wytrzymałości. Aby wykorzystać je jako podkładki, z siewek rzeżuchy słonolistnej usunięto liścienie i merystemy za pomocą brzytwy z podwójnym ostrzem ze stali nierdzewnej, zachowując liścienie. W tych samych sterylnych warunkach, hipokotyl siewek A. thaliana został przecięty poprzecznie na około jedną czwartą wysokości od góry (zwykle 2-3 mm), a górna część siewki została użyta jako zraz. Cięcie A. thaliana jako zrazów można przeprowadzić bezpośrednio w oryginalnych płytkach pożywki lub w płytkach, w których przygotowano rzeżuchę solną jako podkładkę. Zrazy A. thaliana zostały zaszczepione na rzeżusze solnej bez żadnych umocowań, ponieważ niewielka ilość cieczy na powierzchniach cięcia obu części wystarcza do utrzymania ich razem. Następnie szalka Petriego została szybko, ale starannie zaklejona folią parafilmową, aby zachować wilgotność. Należy uważać, aby liście były naturalnie rozłożone, aby zapobiec ewentualnemu przemieszczeniu się z powodu wzrostu roślin.
-
Kultura przeszczepionego organizmu: Zaszczepiony kompleks A/E umieszczono w warunkach SD w komorze wzrostowej Percival na 6-8 dni.
-
Transplantacja zaszczepionych sadzonek (Ryc. 2): Sześć do ośmiu dni po przeszczepieniu badano interfejs złącza przylgowego pod mikroskopem anatomicznym. W tym czasie udany szczep powinien mieć solidne połączenie między zrazem a korzeniami. Sadzonki były następnie przenoszone do systemu hydroponicznego lub gleby odżywczej w zależności od potrzeb. Po przesadzeniu należy zwrócić uwagę na odcięcie korzeni przybyszowych w odpowiednim czasie, jeśli takie się pojawią.
Fig. 2 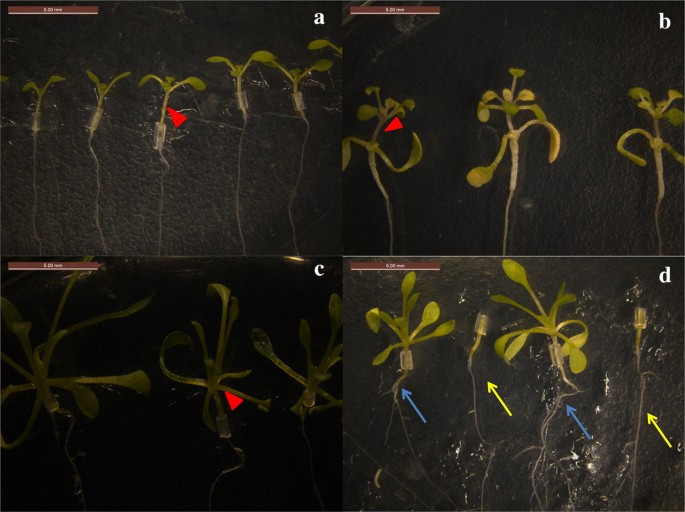
Sadzonki szczepione z sukcesem. a Samosiewy A. thaliana (A/A). b Sadzonki szczepione A/E. c Samosiewy E. salsugineum (E/E). d Sadzonki szczepione E/A. Czerwone strzałki w a-c oznaczają miejsca szczepienia. Korzenie Arabidopsis thaliana jako podkładki są zaznaczone strzałkami w różnych kolorach w d, niebieskie strzałki wskazują korzenie po szczepieniu, a żółte strzałki oznaczają korzenie przed szczepieniem
Dezynfekcja powierzchni nasion
W metodzie szczepienia metodą cut-in, powierzchnia nasion była dezynfekowana bezpośrednio przy użyciu 0.5% chlorowodorku sodu (NaClO) przez 6-8 min, a następnie przemywano sterylną wodą przez 4-6 razy. Metoda ta pozwala na uniknięcie użycia alkoholu do sterylizacji. Ponadto, metoda sterylizacji z NaClO jest prosta, co zmniejsza zanieczyszczenie wtórne, a nasiona mogą kiełkować normalnie. Unika się również niekiełkowania nasion z powodu nadmiernej sterylizacji, która wpływa na kiełkowanie nasion i późniejsze analizy. Tak długo, jak stężenie NaClO jest odpowiednio kontrolowane, nadmierna sterylizacja nie wystąpi, nawet jeśli sterylizacja trwa kilka minut.
Wiek siewek
W metodzie szczepienia przez wcinanie, nieco starsze siewki E. salsugineum (7-10 dni po kiełkowaniu) z korzeniami bocznymi, mogą lepiej sprostać szybkiemu wzrostowi ich zrazów (A. thaliana), to także ogranicza powstawanie korzeni przybyszowych, znacznie poprawia przeżywalność szczepów i zapewnia energiczny wzrost szczepionych siewek w późniejszym etapie (Tabela 1). Stwierdziliśmy, że 3-5 dniowe siewki Arabidopsis były korzystne dla poprawy wskaźnika przeżywalności szczepionych siewek, a także wspierają energiczny wzrost szczepionych siewek (Tabela 1). Może to wynikać z faktu, że cykl życiowy A. thaliana jest krótki, w porównaniu do E. salsugineum. Dlatego użycie starszych siewek A. thaliana jako zrazów skutkowało niską przeżywalnością; nawet jeśli szczepy A/E przetrwały, to wzrost w późniejszych fazach był słaby, a zwykle obserwuje się wczesne kwitnienie.
Metoda cięcia płaską powierzchnią
Wiele typów metod szczepienia zostało opisanych dla A. thaliana . W obecnym badaniu, metoda szczepienia przez wcinanie została zastosowana tylko dla szczepów A/E, a metoda płaskiego cięcia hipokotylu-hipokotylu została użyta dla A/A, E/E i E/A (Rys. 1c, d). Obie metody wymagają tych samych warunków uprawy z wyjątkiem miejsca cięcia. Do samozaszczepiania A/A użyto siewek w wieku 3-5 dni. W przypadku szczepienia E/A, 7-10 dniowe siewki A. thaliana jako podkładki są korzystniejsze dla przetrwania szczepów. Podobnie, 7-10 dniowe siewki zostały użyte do samosiewu E/E. Stwierdzono, że zarówno wskaźnik przeżywalności, jak i późniejszy wzrost siewek A/E różniły się istotnie pomiędzy dwoma metodami szczepienia (Rys. 1a, b i Tabela 2). Metoda „cut-in” jest bardziej satysfakcjonująca dla szczepienia A/E. Głównym powodem może być szybkie tempo wzrostu A. thaliana, które jest lepiej dostosowane do tej metody. Gdy do szczepienia A/E zastosowano tradycyjne cięcie płaskie, korzenie przybyszowe z zraza pojawiają się przed tworzeniem kalusa w miejscu połączenia, co wpływa na wskaźnik sukcesu szczepionych roślin, ponieważ wzrost rzeżuchy słonej jest wolniejszy niż A. thaliana. Dla porównania wskaźnik sukcesu metody szczepienia przez wcinanie wynosi prawie 100%, o ile cięcie jest gładkie, a dwie części ciasno ułożone.
