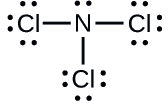Berekening van formele ladingen
De formele lading van een atoom in een molecuul is de hypothetische lading die het atoom zou hebben als we de elektronen in de bindingen gelijkelijk tussen de atomen zouden kunnen herverdelen. Een andere manier om dit te zeggen is dat de formele lading ontstaat wanneer we het aantal valentie-elektronen van een neutraal atoom nemen, de niet-bonding elektronen daarvan aftrekken, en dan het aantal bindingen die met dat atoom in de Lewis-structuur zijn verbonden, daarvan aftrekken.
Dus berekenen we de formele lading als volgt:
Formele lading = (valentie-elektronen van het “vrije” element) – (ongebonden elektronen) – (bindingen).
We kunnen de berekeningen van de formele lading dubbel controleren door de som van de formele ladingen voor de hele structuur te bepalen. De som van de formele ladingen van alle atomen in een molecuul moet nul zijn; de som van de formele ladingen in een ion moet gelijk zijn aan de lading van het ion.
We moeten niet vergeten dat de formele lading die voor een atoom berekend is, niet de werkelijke lading van het atoom in het molecuul is. Formele lading is slechts een handige boekhoudkundige procedure; het geeft niet de aanwezigheid van werkelijke ladingen aan.
Reken formele ladingen toe aan elk atoom in het interhalogeen-ion (\ce{ICl4-}\).
Oplossing
We verdelen de bindingselektronenparen gelijkelijk voor alle bindingen met Cl:
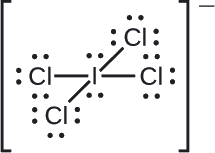
We wijzen eenzame elektronenparen toe aan hun atomen. Elk Cl-atoom heeft nu zeven elektronen toegewezen gekregen, en het I-atoom acht.
Trek dit aantal af van het aantal valentie-elektronen voor het neutrale atoom:
- I: 7 – 8 = -1
- Cl: 7 – 7 = 0
De som van de formele ladingen van alle atomen is gelijk aan -1, wat identiek is aan de lading van het ion (-1).
PageIndex{1})
Bereken de formele lading voor elk atoom in het koolmonoxidemolecuul:

Antwoord
C -1, O +1
Bereken formele lading uit Lewisstructuren
Reken formele ladingen toe aan elk atoom in het interhalogeenmolecuul (\ce{BrCl3}\).
Oplossing
Benoem één van de elektronen in elke Br-Cl binding toe aan het Br atoom en één aan het Cl atoom in die binding:
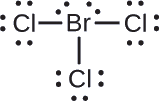
Benoem de lone pairs aan hun atoom. Nu heeft elk Cl-atoom zeven elektronen en het Br-atoom heeft zeven elektronen.
Trek dit aantal af van het aantal valentie-elektronen van het neutrale atoom. Dit geeft de formele lading:
- Br: 7 – 7 = 0
- Cl: 7 – 7 = 0
Alle atomen in een neutraal molecuul hebben een formele lading van nul, en de som van de formele ladingen is in totaal nul, zoals dat ook moet in een neutraal molecuul.
Oefening \PageIndex{2})
Bepaal de formele lading voor elk atoom in \(\ce{NCl3}}).
Antwoord
N: 0; alle drie de Cl-atomen: 0