Magnesiumnitraat, aangeduid met de chemische formule Mg(NO3)2 of MgN2O6, dat de IUPAC-naam magnesiumdinitraat draagt, is een wit kristallijn hygroscopisch poeder dat oplosbaar is in water en alcohol. Het is een magnesiumzout en bevat chemische bindingen die ionisch van aard zijn .

Magnesiumnitraat
Magnesiumnitraat Identificatie |
|
| CAS-nummer | 10377-60-3 |
| PubChem CID | 25212 |
| ChemSpider ID | 23415 |
| EC Nummer | 233-826-7 |
Samenstelling en Synthese
Magnesiumnitraat kan worden bereid door magnesiumsulfaat te combineren met calciumnitraat .
MgSO4 + Ca(NO3)2 = Mg(NO3)2 + CaSO4
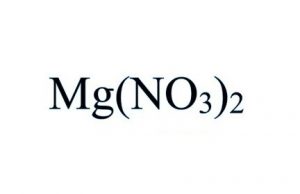
Magnesiumnitraat formule
Eigenschappen en kenmerken van Magnesium Nitraat
Algemene Eigenschappen |
||
| Molaire massa/moleculair gewicht | 148.313 g/mol | |
Fysische eigenschappen |
||
| Kleur/uiterlijk | Witte kristallen | |
| Smeltpunt/vriespunt | 89°C, 192.2°F | |
| kookpunt | 330°C, 626°F | |
| dichtheid | 1.46 g cm-3 | |
| Staat van materie bij kamertemperatuur (normale fase) | Vast | |
Chemische Eigenschappen |
||
| Oplosbaarheid in water | 42 g/100 ml (bij 20oC) | |
| pH | 5-7 (zuur) | |
Atomaire Eigenschappen |
||
| Kristal structuur | Kubisch | |
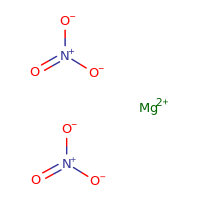
Magnesiumnitraatstructuur
Voornaamste reacties van Mg(NO3)2
Een chemische reactie tussen magnesiumnitraat en natriumcarbonaat levert magnesiumcarbonaat en natriumnitraat op .
Mg(NO3)2 + Na2CO3 = MgCO3 + 2NaNO3
Magnesiumnitraat ontleedt in water waarbij magnesiumhydroxide, ammoniak en zuurstof ontstaan .
Mg(NO3)2 + 4H2O = Mg(OH)2 + 2NH3 + 4O2
Bij verhitting van Mg(NO3)2 ontleedt het in magnesiumoxide, stikstofdioxide en zuurstof .
2Mg(NO3)2 = 2MgO + 4NO2 + O2
Het reageert met natriumhydroxide en geeft magnesiumhydroxide en natriumnitraat .
Mg(NO3)2 + 2NaOH = Mg(OH)2 + 2NaNO3
Magnesiumnitraat toepassingen
- Als een veilige bron van nitraationen .
- Bij de productie van stikstofhoudende meststoffen .
- In pyrotechniek en geconcentreerd salpeterzuur fabricage .
- Helpt bij het prillen en coaten voor de productie van ammoniumnitraat en is een ingrediënt van cosmetica en shampoos .
Is het gevaarlijk
Aangezien het een sterke oxidator is, kan het brandgevaar veroorzaken. Het kan ook ontploffingsgevaar veroorzaken wanneer het in contact komt met organische stoffen. Contact met de ogen, de huid en inademing moet worden vermeden omdat het leidt tot irritatie, hoesten en kortademigheid. Inname in grote hoeveelheden leidt tot buikpijn, duizeligheid, bloederige diarree, braken, stuiptrekkingen, zwakte en instorting.
- Magnesiumnitraat – Pubchem.ncbi.nlm.nih.gov
- Magnesiumnitraat – Chemspider.com
- Magnesiumnitraat – Americanelements.com
- Magnesiumnitraat – Sciencemadness.org
- Magnesiumnitraat-hexahydraat – Sigmaaldrich.com
- Magnesiumnitraat – Chemicalbook.com
- Vraag: Magnesiumnitraat en natriumcarbonaat Mg(NO_3)_2 + Na_2 – Chegg.com
- Hoe wordt de evenwichtsvergelijking van magnesiumnitraat plus water bepaald? – Quora.com
- De thermische ontleding van magnesiumnitraat – Chemiday.com
- Vraag: Natriumhydroxide reageert met magnesiumnitraat tot magnesiumhydroxide – Chegg.com