Inleiding
Chronic Obstructive Pulmonary Disease (COPD) is een ernstige longaandoening, die langzaam progressief is met systemische repercussies; ze treft vooral mensen ouder dan 40 jaar.1 COPD is echter te voorkomen en te behandelen. Veel patiënten krijgen te maken met COPD-exacerbaties en sommige daarvan vereisen bezoeken aan de Spoedeisende Hulp (SEH) en ziekenhuisopnames. In Portugal, en hoewel ziekenhuisopnames als gevolg van COPD tussen 2009 en 2016 met 8% zijn gedaald, vertegenwoordigden ze in 2016 nog steeds 8049 in het ziekenhuis opgenomen patiënten. Ziekenhuisopnames van patiënten van 80 jaar of ouder stegen van 28,4% in 2005 tot 38,0% in 2014, wat een vergrijzende bevolking weerspiegelt,2 met mogelijk meer comorbiditeiten.
Een passend beheer van COPD-exacerbaties vormt een belangrijke klinische uitdaging.3 In 70% tot 80% van de COPD-exacerbaties is de precipiterende factor een luchtweginfectie,4 maar in ongeveer een derde van de ernstige exacerbaties van COPD kan geen oorzaak worden geïdentificeerd,1 wat een goede begeleiding van de therapeutische strategie bemoeilijkt. Er bestaan verschillende diagnostische instrumenten om een exacerbatie en de ernst ervan te beoordelen, wat zal helpen bij beslissingen zoals of de patiënt thuis of in een eerstelijnsgezondheidszorgsetting kan worden behandeld of dat hij/zij moet worden doorverwezen naar een spoeddienst en uiteindelijk moet worden opgenomen.1,5-7 De ernst van een exacerbatie zal de behandeling ervan beïnvloeden,1,7,8 en prognostische scores moeten worden gebruikt om het risico van een toekomstige exacerbatie te voorspellen. Er zijn drie prognostische scores voorgesteld op basis van biologische en klinische kenmerken van exacerbaties: de BAP-65 score,9 de DeCOPD score9 en de score voorgesteld door Roche et al.10,11
Nadat een exacerbatie op de juiste manier is behandeld, moet een geschikt ontslagplan worden opgesteld. Dit zal afhangen van de ernst van de exacerbatie, maar moet in het algemeen een herclassificatie van de patiënt volgens de GOLD-criteria,1 optimalisatie van farmacologische therapie,1,4,8 beheer van comorbiditeiten, educatie van de patiënt (of verzorger thuis) over het juiste gebruik van medicatie,1,8 verwijzing naar een longartsenpraktijk als ze daar nog niet aanwezig zijn, en een programma voor stoppen met roken en longrevalidatie omvatten.
ExacerbatiesDefinitie, oorzaken en etiologieDefinitie
Er is momenteel geen exacte of consistente definitie van een COPD-exacerbatie. De definitie van exacerbatie in de GOLD-update van 2016,12 “een acute gebeurtenis die wordt gekenmerkt door een verslechtering van de ademhalingssymptomen van de patiënt die de normale dagelijkse variaties te boven gaat en leidt tot een verandering in medicatie”, werd in het GOLD-document van 201713 vereenvoudigd tot “een acute verslechtering van de ademhalingssymptomen die leidt tot aanvullende therapie”.
Oorzaken en etiologie
Er zijn verschillende factoren geïdentificeerd die kunnen leiden tot een verergering van de symptomen, en in 70% tot 80% van de gevallen van COPD-exacerbatie is de uitlokkende factor een luchtweginfectie,4 hetzij viraal4,9,14,15 hetzij bacterieel,4,9,15 maar in ongeveer een derde van de ernstige exacerbaties van COPD kan geen oorzaak worden vastgesteld.1
Het is belangrijk om de onderliggende oorzaak van een exacerbatie vast te stellen, omdat dit de therapeutische strategie zal sturen.
Classificatie
Net als bij het ontbreken van een definitie van een exacerbatie, bestaat er geen consensueel classificatiesysteem om de ernst van de exacerbatie te beoordelen, hoewel er enkele zijn voorgesteld.16 Enkele van deze scores zullen verder worden besproken.
Bij milde exacerbaties is er een verergering van de symptomen die thuis kan worden behandeld, met een verhoging van de dosering van de reguliere medicatie.1,6,17 Matige exacerbaties reageren niet op een verhoogde dosering bronchusverwijders en vereisen daarom behandeling met systemische corticosteroïden en/of antibiotica.1,6,17,18 Ernstige exacerbaties vereisen ziekenhuisopname of evaluatie op de SEH1,6,17,18 en hebben een ernstige impact op lichamelijke activiteit. Zeer ernstige exacerbaties vereisen opname op een Intensive Care Unit (ICU)1 en hebben een zeer ernstige impact op lichamelijke activiteit. Infectieuze exacerbaties worden gekenmerkt door toename van het volume en de purulentie van het sputum in combinatie met verergering van de dyspnoe en moeten worden behandeld met antibiotica.1,8
Diagnostische instrumenten
De beoordeling van een exacerbatie en de ernst ervan is gebaseerd op de medische voorgeschiedenis van de patiënt,1,6 bv. luchtstroombeperking, duur van de verergering van de symptomen en het aantal eerdere episoden (totaal/opnames in het ziekenhuis). Symptomen zoals ademnood, hoest of sputum,7 zuurstofsaturatieniveaus,7 nieuwe beperking van dagelijkse activiteiten,6,7 klinische tekenen van ernst zoals gebruik van accessoire ademhalingsspieren,1,5 paradoxale borstwandbewegingen,1,5 verergering of nieuw begin van centrale cyanose,1,7 ontwikkeling van perifeer oedeem,1,7 hemodynamische instabiliteit,1 verslechterde mentale status1,6,7 en comorbiditeiten1 moeten allemaal worden beoordeeld. Bij alle patiënten moet een pulsoximetrie worden uitgevoerd.6 Als een patiënt naar een ziekenhuis wordt doorverwezen, moeten arteriële bloedgassen worden gemeten5,6,8,15,19-21 en moet een röntgenfoto van de borstkas worden gemaakt om comorbiditeiten en/of andere longziekten uit te sluiten.1,6,8,15,19 In deze gevallen wordt ook een ECG1,6,19,20, een bloedbeeld1,6,8,20-22 en biochemische basistests, waaronder elektrolytenconcentraties1,8,20,21, ureum1,20, glycemie1,20 en een metabool panel aanbevolen.6 Bij patiënten die theofylline-therapie krijgen, moeten bij opname de theofylinespiegels worden gemeten en moeten bloedkweken worden afgenomen als de patiënt koorts heeft.8 Kweek van sputummonsters wordt in de routinepraktijk niet aanbevolen, alleen als het sputum purulent is,8 en het GOLD 2018-document beveelt sputumkweek en een antibioticagevoeligheidstest alleen aan als een infectieuze exacerbatie niet reageert op de empirische antibioticabehandeling.1 Sommige auteurs noemen een eosinofiel bloedbeeld als een aan te raden procedure om de therapie van COPD-exacerbaties te begeleiden, omdat is gesuggereerd dat eosinofiele exacerbaties mogelijk beter reageren op systemische steroïden.1,15 Spirometrie wordt niet aanbevolen tijdens een exacerbatie.1
Als de exacerbatie ernstig is en de patiënt in het ziekenhuis is opgenomen, moeten de niveaus van hersennatriuretisch peptide en hartenzymmetingen worden overwogen, vooral als de patiënt niet reageert op de conventionele behandeling.6 Ook moet farynxswab of sputum worden getest op virussen en bacteriën14,20,23 en moet serum C-reactief proteïne worden gemeten.14,20,24 Procalcitonine kan een leidraad zijn voor antibioticatherapie, aangezien het is gesuggereerd als een meer specifieke marker voor bacteriële infecties en dat van waarde kan zijn bij het nemen van een beslissing over het voorschrijven van antibiotica.1 De Charlson comorbiditeitsindex,5,20,21,23 de gemodificeerde Medical Research Council (mMRC) dyspneuschaal,5,20,21,23 fysieke activiteit5 en algemene gezondheid5 moeten worden beoordeeld. De auteurs adviseren niet om in Portugal routinematig de COPD Assessment Test (CAT)-score23 te gebruiken, aangezien deze niet gevalideerd is voor de Portugese populatie. Als de patiënt wordt opgenomen op de IC, moet naast de tests die worden aanbevolen bij ernstige exacerbaties, de Glasgow Coma Scale5 worden gebruikt, luchtweginfecties worden onderzocht25 en een hemocultuur worden uitgevoerd.24 Volgens het GOLD 2018-document moeten alleen patiënten die niet-invasieve beademing (NIV) of invasieve beademing (IV) nodig hebben, in het ziekenhuis worden opgenomen.1
Pharmacologische strategieënLABA+LAMA
Kortwerkende geïnhaleerde β2-agonisten (SABA’s) en kortwerkende muscarine-antagonisten (SAMA’s) blijven de steunpilaar bij de behandeling van symptomen en luchtwegobstructie tijdens COPD-exacerbaties.1,4,6 Hoewel er ten tijde van de publicatie van het GOLD 2018-document geen klinische studies waren die het nut van langwerkende β2-agonisten (LABA) of langwerkende muscarine-antagonisten (LAMA) bij exacerbaties evalueerden, is de aanbeveling om deze medicatie tijdens de exacerbatie voort te zetten of er zo snel mogelijk voor ziekenhuisontslag mee te starten.1 De LABA+LAMA combinatie heeft een gedocumenteerd voordeel bij het verminderen van exacerbaties wanneer deze wordt voorgeschreven aan patiënten in de stabiele fase van COPD,26 met name de indacaterol/glycopyrronium combinatie zoals aangetoond in de SPARK27 en FLAME28 studies. Bovendien toonde de recente FLAME-studie,28 de eerste prospectieve studie die eosinofilie in het bloed evalueerde als biomarker van therapeutische respons, aan dat indacaterol/glycopyrronium een significante verbetering van de longfunctie liet zien in vergelijking met salmeterol/fluticason voor alle geanalyseerde cutoffs.29 Een recente post hoc analyse van de WISDOM studie identificeerde een subgroep van patiënten – patiënten met ≥2 exacerbaties en ≥400 cellen/μL – die een verhoogd risico op exacerbatie lijken te lopen wanneer ICS wordt gestaakt.30 In feite, en volgens de meest recente versie van het GOLD document,1 kunnen symptomatische patiënten in de stabiele fase van COPD en een voorgeschiedenis van ≥2 matige exacerbaties, of 1 met ziekenhuisopname, in het afgelopen jaar, baat hebben bij een ICS bovenop LABA/LAMA. Het moet echter nog worden vastgesteld of eosinofielen in het bloed kunnen worden gebruikt als biomarker om de werkzaamheid van ICS te voorspellen in termen van preventie van exacerbaties, zoals gesuggereerd door de post-hocanalyse van WISDOM.1
Antibiotica, corticosteroïden en xanthines
Bij de behandeling van een exacerbatie wordt het toevoegen van orale of intraveneuze corticosteroïden en/of antibiotica aanbevolen, afhankelijk van de ernst van de symptomen en de aanwezigheid van infectie.1,4,6-8,31 Antibiotica mogen alleen worden gebruikt voor de behandeling van infectieuze4,6,8,31 of ernstige exacerbaties.31 De GOLD 2018 en NHS 2014 documenten bevelen antibiotica aan voor patiënten met COPD exacerbaties die drie kardinale symptomen hebben – toename van dyspneu, sputumvolume en sputum purulentie7 (Evidence B)1; twee van de kardinale symptomen hebben, als toegenomen purulentie van sputum een van de twee symptomen is7 (Evidence C)1; of mechanische beademing (invasief of niet-invasief) nodig hebben (Evidence B).1
Antibiotica blijken het risico van kortetermijnsterfte, mislukte behandeling en purulentie van sputum te verminderen, en een studie bij COPD-patiënten met exacerbaties die (invasieve of niet-invasieve) mechanische beademing nodig hebben, wees uit dat het niet behandelen met antibiotica geassocieerd was met een verhoogde mortaliteit en een grotere incidentie van secundaire nosocomiale pneumonie.1 Een Cochrane-review concludeerde dat antibiotica voor zeer ernstige COPD-exacerbaties brede en consistente gunstige effecten vertoonden voor de uitkomsten van patiënten die op een IC waren opgenomen,32 maar deze conclusie was gebaseerd op gegevens van één enkele studie.32
Het NHS-protocol voor het beheer van COPD-exacerbaties in de eerstelijnszorg stelt dat bronchusverwijders en corticosteroïden de steunpilaar van de behandeling van exacerbaties zijn.7 Een systematische review van 19 COPD-richtlijnen meldde echter dat de criteria voor het behandelen van patiënten met antibiotica grotendeels gebaseerd waren op een toename van de respiratoire symptomen, terwijl systemische corticosteroïden vaak universeel werden aanbevolen voor alle patiënten met acute exacerbaties.33 De auteurs concludeerden ook dat de huidige COPD-richtlijnen weinig hulp bieden bij het identificeren van patiënten met acute exacerbaties die waarschijnlijk baat hebben bij behandeling met systemische corticosteroïden en antibiotica in de eerstelijnszorg, wat kan bijdragen aan overgebruik of ongepast gebruik van een van beide behandelingen.
Sommige biomarkers zijn gesuggereerd als nuttig voor het optimaliseren van antibioticabehandeling. Het GOLD 2018-document1 beveelt niet aan om CRP routinematig te gebruiken, maar stelt dat verschillende studies hebben gesuggereerd dat procalcitonine-gestuurde antibioticabehandeling de blootstelling aan antibiotica en bijwerkingen vermindert met dezelfde klinische werkzaamheid. Deze observatie wordt bevestigd door een Cochrane review die aantoont dat procalcitonine de antibioticatherapie kan sturen.32 Andere auteurs melden daarentegen dat CRP een waardevollere marker zou kunnen zijn,34 en een real-life studie in de eerstelijnsgezondheidszorg concludeerde dat het uitvoeren van CRP-sneltesten ertoe leidde dat huisartsen minder antibiotica voorschreven dan degenen die dat niet deden.35
Bij alle patiënten moet de keuze van het antibioticum worden ingegeven door het lokale bacteriële resistentiepatroon,1,8 het microbiologische verhaal van de patiënt en zijn/haar risicofactoren.
In het algemeen bestaat de initiële empirische behandeling uit aminopenicilline met clavulaanzuur, een macrolide of een tetracycline.1,8 Langdurig gebruik van macroliden kan echter gepaard gaan met belangrijke bijwerkingen en het risico van het ontwikkelen van bacteriële resistentie.36 Sputum moet worden opgestuurd voor kweek (in het geval van patiënten met frequente exacerbaties, ernstige luchtstroombeperking en/of exacerbaties waarvoor mechanische beademing nodig is1), omdat er gramnegatieve bacteriën (bijv. Pseudomonas-soorten) of resistente ziekteverwekkers aanwezig kunnen zijn die niet gevoelig zijn voor de hierboven genoemde antibiotica.1
Hoewel de meest effectieve behandelingsduur nog moet worden vastgesteld,32 is de aanbevolen duur van de antibioticatherapie gewoonlijk 5-7 dagen (Bewijs D)1, maar de behandelingsduur zal afhangen van het gebruikte antibioticum.
Het beheer van exacerbaties in de eerstelijnszorg moet bestaan uit maximalisering van bronchusverwijdende therapie en systemische corticosteroïden indien niet gecontra-indiceerd (30mg prednisolon) gedurende 7 dagen.1,7,8 Therapie met oraal prednisolon is even effectief als intraveneuze toediening.1 Het GOLD 2018 document beveelt een dosis van 40mg prednison per dag gedurende 5 dagen aan1 terwijl NICE 2016 een dosis van 30mg gedurende 7-14 dagen aanbeveelt en verder aanbeveelt dat een kuur van corticosteroïden niet langer dan 14 dagen mag duren omdat er geen voordeel is bij een langere therapie.8 Het gebruik van systemische corticosteroïden bij COPD-exacerbaties blijkt de hersteltijd te verkorten, de longfunctie te verbeteren, de oxygenatie te verbeteren, het risico op vroegtijdige terugval en falen van de behandeling te verminderen, en de duur van de ziekenhuisopname te verminderen.1
Een meta-analyse bevestigde dat het behandelsucces toenam met systemische corticosteroïden in vergelijking met gebruikelijke zorg bij COPD-exacerbaties. Corticosteroïden lijken voor de gehele populatie gunstig te zijn wat betreft het behandelingssucces.37
Enkele studies suggereren dat corticosteroïden mogelijk minder effectief zijn bij de behandeling van acute COPD-exacerbaties bij patiënten met lagere niveaus van eosinofielen in het bloed.15,38
Wat betreft methylxanthines bij de behandeling van COPD-exacerbaties, het huidige bewijs ondersteunt het gebruik ervan niet, gezien het feit dat de mogelijke gunstige effecten op de longfunctie en klinische eindpunten bescheiden en inconsistent zijn, terwijl de bijwerkingen aanzienlijk zijn.1,4,6,31 Intraveneuze methylxanthines (theofylline of aminofylline) kunnen worden beschouwd als tweedelijns therapie en worden gebruikt als add-on wanneer er onvoldoende respons is. Bij gebruik van theofylline is het noodzakelijk de bloedspiegels, bijwerkingen en mogelijke interacties tussen geneesmiddelen te controleren.8,31
Therapeutica – risicostratificatie
Exacerbaties van COPD kunnen worden ingedeeld in mild, matig, ernstig6 en zeer ernstig. Zeer ernstige exacerbaties vereisen opname op de ICU, met invasieve beademing, en vallen buiten het bestek van dit artikel.
Zoals eerder vermeld, zijn exacerbaties van COPD zeer heterogeen, waardoor het bijzonder relevant is om hun etiologie, pathologie, ernst en risico vast te stellen, aangezien al deze factoren gevolgen zullen hebben voor de prognose, de farmacologische behandeling en de plaats van behandeling.
Wat de farmacologische behandeling en de plaats van behandeling betreft: als de exacerbaties mild en niet-infectieus zijn,1,4,7,8,31 kunnen zij thuis worden behandeld met een verhoging van de dosering onderhoudsbronchodilatoren.6,17 Als de exacerbatie infectieus is4,8,31 moet een antibioticum worden gegeven.1,7
Matige exacerbaties moeten op de SEH worden behandeld en de patiënt moet daarna worden ontslagen omdat deze exacerbaties geen ziekenhuisopname vereisen, tenzij de ziekenhuisopname om sociaaleconomische redenen plaatsvindt. De dosering van onderhoudsbronchusverwijders moet worden verhoogd6,17 en de patiënt moet gedurende 5 dagen een oraal corticosteroïd6,17,18 krijgen.1,38,39 Als de exacerbatie infectieus is4,8,31 moet een antibioticum worden gegeven.1,7
In het geval van een patiënt die een ernstige exacerbatie heeft gehad, waarvoor ziekenhuisopname nodig was, moet de patiënt worden geherclassificeerd als een frequente exacerbator. Gewoonlijk vereist ziekenhuisopname wegens een ernstige exacerbatie wijziging van de onderhoudsbehandeling met inhalatie, waaronder O2 als de patiënt hypoxemisch is en niet-invasieve beademing als de patiënt hypercapnie heeft, groter dan 52 cm H2O en/of acidemie,1,4,6,8 orale of intraveneuze corticosteroïden (gedurende 5 dagen)1,38,39 en antibiotica indien infectieus,1,7 xanthines als er onvoldoende respons op de behandeling is4,8,16,31 en preventie van pulmonale trombo-embolie.
Ontslag – actieplan
Patiënten met milde exacerbaties moeten na drie maanden opnieuw worden beoordeeld, met spirometrie en een herevaluatie van de GOLD-graad en, indien van toepassing, herclassificatie.
Bij ontslag na een matige exacerbatie moet bronchodilatatie worden geoptimaliseerd, anti-pneumokokkenvaccinatie worden voorgeschreven, en een plan voor stoppen met roken en ademhalingsrevalidatie worden opgesteld.
Bij ontslag na een ernstige exacerbatie moet optimale onderhoudstherapie1,4,8 met LABA, LAMA en ICS worden voorgeschreven. Patiënten die een episode van ademhalingsfalen hebben doorgemaakt, moeten vóór ontslag bevredigende resultaten van oximetrie of arteriële bloedgassen hebben. Patiënten (of thuisverzorgers) moeten de juiste informatie krijgen zodat ze het juiste gebruik van medicatie, inclusief inhalatoren en zuurstof, volledig begrijpen, en indien nodig moeten afspraken worden gemaakt over follow-up en thuiszorg (zoals een bezoekverpleegkundige, zuurstoftoediening, doorverwijzing voor andere ondersteuning). De patiënt, de verzorger van de patiënt en de arts moeten erop kunnen vertrouwen dat hij of zij het nieuwe behandelingsplan met succes kan uitvoeren. Bij twijfel over het vermogen van de patiënt om zijn/haar therapie te beheren, kan een formele beoordeling van de activiteiten van het dagelijks leven nuttig zijn.8 Het GOLD 2018-document biedt een lijst met ontslagcriteria.1 Voor patiënten die hypoxemisch zijn tijdens een exacerbatie, moeten arteriële bloedgassen en/of pulsoximetrie worden geëvalueerd vóór ontslag uit het ziekenhuis en in de daaropvolgende 3 maanden. Indien de patiënt hypoxemisch blijft, kan langdurige zuurstoftoediening nodig zijn.1 Ook moeten de patiënten duidelijke instructies krijgen over wanneer en hoe zij hun behandeling met corticosteroïden moeten staken.1,8 Wat de behoefte aan geïndividualiseerde zorg betreft, werd in een Canadees onderzoek waarbij de patiënten na ontslag een telefoontje, een huisbezoek en voortzetting van de zorg kregen aangeboden, geconcludeerd dat het aantal heropnames na 30 en 90 dagen weliswaar niet afnam, maar dat het totale sterftecijfer na 90 dagen wel afnam. Deze gegevens suggereren dat de geïndividualiseerde zorg in deze studie een impact kan hebben op de COPD morbiditeit en mortaliteit na een acute exacerbatie.40 Alle patiënten die een ernstige exacerbatie hebben doorgemaakt, moeten 4 tot 6 weken na ontslag uit het ziekenhuis opnieuw worden beoordeeld1 , krijgen een voorschrift voor een anti-pneumokokkenvaccinatie en er moet een plan voor stoppen met roken en ademhalingsrevalidatie worden opgesteld – Fig. 1.
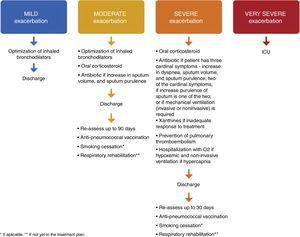
Voorgestelde therapie, ontslag en follow-up van milde, matige, ernstige en zeer ernstige COPD-exacerbaties.
De auteurs stellen voor dat de patiënt 10 tot 20 dagen na ontslag van de SEH of het ziekenhuis een anti-pneumokokkenvaccin krijgt voorgeschreven.
Tijdens de vervolgconsultatie (drie maanden voor matige exacerbaties en 4-6 weken voor ernstige exacerbaties) moeten spirometrie en arteriële bloedgassen worden gemeten. Symptomen, correct gebruik van inhalatietherapie en adequaat beheer van comorbiditeiten moeten opnieuw worden beoordeeld. De farmacologische behandeling moet worden geoptimaliseerd. Het plan om te stoppen met roken en de respiratoire revalidatie moeten worden geëvalueerd. Een nieuwe follow-up consultatie moet worden gepland binnen de komende 30-60 dagen.
Conclusies
Identificatie van de onderliggende oorzaak van COPD exacerbaties en beoordeling van de ernst ervan is fundamenteel voor het sturen van de behandeling. Nadat een exacerbatie op de juiste manier is behandeld, moet een geschikt ontslagplan worden opgesteld dat afhankelijk is van de ernst van de exacerbatie. Een goed ontslagplan zal de last van de symptomen verminderen, bijdragen tot een sneller herstel, de levenskwaliteit van de patiënt verhogen en toekomstige exacerbaties voorkomen of uitstellen. Verwijzing naar een pulmonologisch spreekuur als de patiënt daar nog niet naar toe gaat, is van het grootste belang.
Belangenverstrengeling
AR verklaart spreekvergoedingen te hebben ontvangen van AstraZeneca, Boehringer Ingelheim, Novartis, Bial, Medinfar, Mundipharma, Menarini, Grifols, Mylan, Tecnifar, Teva en cslbehring. CA verklaart spreekvergoedingen te hebben ontvangen van AstraZeneca, Pfizer, Novartis en Mundipharma. SF verklaart geen belangenconflicten te hebben. JF verklaart spreekvergoedingen te hebben ontvangen van AstraZeneca, Boehringer Ingelheim, Diater, Inmunotek, Menarini, Mundipharma, Mylan, Tecnifar en TEVA, en deel te hebben genomen aan adviesraden van Bial, GSK en Novartis. MD verklaart honoraria te hebben ontvangen voor lezingen van AstraZeneca, Boehringher Ingelheim, Bial, GSK, Menarini en Novartis, en voor deelname aan adviesraden van Bial, GSK en Novartis. CRC declareert spreekvergoedingen van Boehringer Ingelheim, Roche, Novartis, AstraZeneca, Pfizer vaccins, Teva, Menarini, Medinfar en Tecnifar, en deelname aan adviesraden van Boehringer Ingelheim, Roche, Novartis, GSK, AstraZeneca en Pfizer vaccins.