.jpg) De productie van ammoniak is van cruciaal belang voor de landbouwindustrie in de wereld, want daaruit worden alle meststoffen geproduceerd die stikstof bevatten.
De productie van ammoniak is van cruciaal belang voor de landbouwindustrie in de wereld, want daaruit worden alle meststoffen geproduceerd die stikstof bevatten.
Toepassingen van ammoniak
De productie van meststoffen is verreweg het belangrijkste gebruik van ammoniak. Hieronder vallen ureum, ammoniumzouten (ammoniumfosfaten, ammoniumnitraat, calciumammoniumnitraat) en oplossingen van ammoniak.
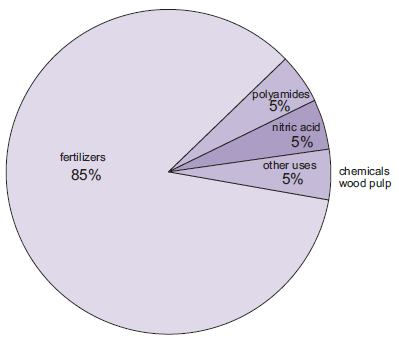
Figuur 1 De toepassingen van ammoniak.
Een toenemende hoeveelheid ammoniak, hoewel nog steeds klein in vergelijking met andere toepassingen, wordt gebruikt als geconcentreerde oplossing bij de bestrijding van de uitstoot van stikstofoxiden door elektriciteitscentrales.
De jaarlijkse productie van ammoniak
Ammoniak komt op de tweede plaats, na zwavelzuur, als de chemische stof met de grootste tonnage. Het wordt in toenemende mate geproduceerd in landen met goedkope aardgas- en steenkoolbronnen (China en Rusland zijn goed voor ongeveer 40%). De grootste fabrieken produceren ongeveer 3000 ton per dag en er zijn plannen om fabrieken te bouwen die 4000-5000 ton per dag produceren, wat zou betekenen dat de totale wereldproductie met 100 van dergelijke eenheden zou kunnen worden beheerd. De huidige produktie bedraagt:
| Wereld | 146 miljoen ton |
| China | 48 miljoen ton |
| Rusland | 12 miljoen ton |
| India | 11 miljoen ton |
| 9 miljoen ton | |
| Indonesië | 5 miljoen ton |
| Trinidad en Tobago | 5 miljoen ton |
| Oekraïne | 4 miljoen ton |
Gegevens van:
U.S. Geological Survey, Mineral Commodity Summaries, 2016.
De toename van het tonnage ammoniak dat wordt gemaakt, houdt net gelijke tred met de toenemende wereldbevolking en met haar stijgende levensstandaard. Verwacht wordt dat de vraag naar ammoniak zal toenemen tot bijna 200 miljoen ton in 20181.
1. International Fertilizer Association, 2014.
Bereiding van ammoniak
De bereiding van ammoniak uit stikstof en waterstof verloopt in twee hoofdfasen:
a) de bereiding van waterstof
b) de synthese van ammoniak (het Haber-proces)
Bij de bereiding van waterstof zijn verschillende processen betrokken. Figuur 2 toont de opeenvolging ervan en de plaats binnen een ammoniakfabriek (stappen 1-5). De convertor die wordt gebruikt om van de waterstof ammoniak te maken, is ook afgebeeld (stap 6). Wat er in elk van deze stappen gebeurt, wordt onder de figuur beschreven.
|
Figuur 2 Een ammoniakfabriek in West-Australië: 1 Ontzwavelingseenheden |
.jpg) |
(a) De productie van waterstof
Waterstof wordt geproduceerd uit verschillende grondstoffen, meestal uit aardgas, steenkool of nafta. De manieren waarop waterstof uit deze grondstoffen wordt verkregen, worden afzonderlijk behandeld.
Waterstof uit aardgas (methaan)
Dit gebeurt in twee fasen:
i) de vervaardiging van synthesegas (een mengsel van koolmonoxide en waterstof (stoomreforming))
ii) de verwijdering van het koolmonoxide en de produktie van een mengsel van waterstof en stikstof (de verschuivingsreactie)
i) De vervaardiging van synthesegas
Op welke wijze het methaan ook wordt verkregen, het zal enige organische zwavelverbindingen en waterstofsulfide bevatten, die beide moeten worden verwijderd. Anders zullen zij de katalysator vergiftigen die nodig is voor de vervaardiging van synthesegas. In de ontzwavelingseenheid worden de organische zwavelverbindingen vaak eerst omgezet in waterstofsulfide, alvorens te reageren met zinkoxide. De grondstof wordt gemengd met waterstof en bij ca. 700 K over een katalysator van gemengde kobalt- en molybdeenoxiden op een inerte drager (een speciaal behandeld aluminiumoxide) geleid.
.jpg)
Daarna worden de gassen bij ca. 700 K over zinkoxide geleid en wordt waterstofsulfide verwijderd:
.jpg)
Primary steam reforming zet methaan en stoom om in synthesegas, een mengsel van koolmonoxide en waterstof:
.jpg)
Hoge temperaturen en lage drukken bevorderen de vorming van de producten (het principe van Le Chatelier). In de praktijk worden de reagentia over een nikkelkatalysator geleid, die fijn verdeeld is op het oppervlak van een calciumoxide/aluminiumoxide drager in verticale buizen van een nikkellegering. De buizen, tot 350 in parallel, worden verwarmd in een oven boven 1000 K en onder een druk van ongeveer 30 atm. Dit is een voorbeeld van een buisvormige reactor.
Door secundaire stoomreforming reageert zuurstof uit de lucht met een deel van de aanwezige waterstof en het resulterende mengsel wordt over een nikkelkatalysator geleid. De stoom en de warmte die bij de verbranding vrijkomen, hervormen het grootste deel van het resterende methaan. De belangrijkste reacties zijn:
small.jpg)
Het gas dat uit deze exotherme fase vrijkomt, heeft een temperatuur van ca. 1200 K en wordt gekoeld in warmtewisselaars. De stoom die wordt gevormd uit het water dat wordt gebruikt om de gassen af te koelen, wordt gebruikt om turbines en dus compressoren te laten draaien en om de reactanten voor te verwarmen.
Sommige recente ontwerpen gebruiken afvalwarmte van de secundaire reformer direct om warmte te leveren voor de primaire reformer.
In dit stadium bevat het gas waterstof, stikstof, koolmonoxide en kooldioxide en ongeveer 0,25% methaan. Aangezien lucht 1% argon bevat, hoopt dit zich ook op in het synthesegas.
(ii) De verschuivingsreactie
Dit proces zet koolmonoxide om in kooldioxide, terwijl meer waterstof wordt gegenereerd.
Het vindt plaats in twee fasen. In de eerste fase, de verschuivingsreactie bij hoge temperatuur, wordt het gas gemengd met stoom en bij ongeveer 700 K in een reactor met een vast bed over een ijzer/chroom(III)oxidekatalysator geleid. Hierdoor daalt de koolmonoxideconcentratie van 11%:
.jpg)
In de tweede fase, de lage-temperatuurverschuivingsreactie, wordt het gasmengsel over een koper-zinkkatalysator geleid bij ca 500 K. De koolmonoxideconcentratie wordt verder verlaagd tot 0,2%.
De reactie wordt om verschillende redenen in twee fasen uitgevoerd. De reactie is exotherm. Bij hoge temperatuur is de uitgangsconcentratie van koolmonoxide echter nog vrij hoog, als gevolg van de evenwichtsregeling. De koperkatalysator die in de lagetemperatuurfase wordt gebruikt, is zeer gevoelig voor hoge temperaturen, en zou in de hogetemperatuurfase niet effectief kunnen werken. Daarom wordt het grootste deel van de reactie bij hoge temperatuur uitgevoerd om het grootste deel van de warmte terug te winnen. Het gas wordt dan verwijderd bij lage temperatuur, waar het evenwicht veel gunstiger is, op de zeer actieve maar onstabiele koperkatalysator.
Het gasmengsel bevat nu ongeveer 18% kooldioxide, dat wordt verwijderd door het gas te wassen met een oplossing van een base, met gebruikmaking van een van de verschillende beschikbare methoden. De voorkeur wordt gegeven aan een organische base (in de kooldioxide-absorber), een oplossing van een ethanolamine, vaak 2,2′-(methylimino)bis-ethanol (N-methyldiethanolamine).
De kooldioxide komt vrij bij verhitting van de oplossing in de kooldioxidestripper). Veel ervan wordt vloeibaar gemaakt en verkocht, bijvoorbeeld voor koolzuurhoudende dranken, als koelmiddel voor kerncentrales en om de groei van planten in kassen te bevorderen.
De laatste sporen van koolstofoxiden worden verwijderd door de gassen bij 600 K over een nikkelkatalysator te leiden:
.jpg)
Dit proces staat bekend als methanisering. Er wordt een gas verkregen met een typische samenstelling: 74% waterstof, 25% stikstof, 1% methaan, samen met wat argon.
Waterstof uit nafta
Als nafta als grondstof wordt gebruikt, is een extra reforming-stap nodig. De nafta wordt verhit tot een damp, vermengd met stoom en door buizen geleid, verhit bij 750 K en verpakt met een katalysator, nikkel ondersteund op een mengsel van aluminium- en magnesiumoxiden. Het hoofdproduct is methaan samen met koolstofoxiden, en wordt vervolgens verwerkt door middel van stoomreforming, alsof het aardgas was, gevolgd door de verschuivingsreactie.
Waterstof uit steenkool
Als steenkool wordt gebruikt, wordt deze eerst fijngemalen en verhit in een atmosfeer van zuurstof en stoom. Een deel van de steenkool verbrandt zeer snel in zuurstof (in minder dan 0,1 s) waardoor de temperatuur in de oven stijgt en de rest van de steenkool reageert met de stoom:
.jpg)
Het gas dat vrijkomt bevat ca 55% koolmonoxide, 30% waterstof, 10% kooldioxide en kleine hoeveelheden methaan en andere koolwaterstoffen. Dit mengsel wordt behandeld door de verschuivingsreactie.
De belangrijkste problemen bij het gebruik van steenkool zijn de grote hoeveelheden zwaveldioxide en trioxide die vrijkomen bij de verbranding van steenkool en de aanzienlijke hoeveelheden andere onzuiverheden zoals arseen en broom, die allemaal zeer schadelijk zijn voor de atmosfeer en die allemaal ernstige vergiften zijn voor de katalysatoren in het proces. Er is ook een enorm probleem met de verwijdering van de as.
Waterstof uit biomassa
Synthesegas kan worden geproduceerd uit biomassa. Het proces wordt geschetst in de unit over bioraffinaderijen.
(b) De fabricage van ammoniak (Het Haber-proces)
.jpg)
Het hart van het proces is de reactie tussen waterstof en stikstof in een reactor met een vast bed. De gassen, in stoichiometrische verhoudingen, worden verhit en onder druk over een katalysator geleid (figuur 3).
.jpg)
Figuur 3 Een schema van een conventionele synthesereactor (een convertor).
Het ammoniakaandeel in het evenwichtsmengsel neemt toe met toenemende druk en met afnemende temperatuur (principe van Le Chatelier). De kwantitatieve gegevens zijn vermeld in tabel 1. Om een redelijke opbrengst en gunstige snelheid te verkrijgen, worden hoge druk, gematigde temperatuur en een katalysator gebruikt.
| Percentage ammoniak aanwezig bij evenwicht bij een reeks temperaturen | ||||||
|---|---|---|---|---|---|---|
| 373 K | 473 K | 573 K | 673 K | 773 K | 973 K | |
| 10 | – | 50.7 | 14.7 | 3.9 | 1.2 | 0.2 |
| 25 | 91.7 | 63.6 | 27.4 | 8.7 | 2.9 | – |
| 50 | 94.5 | 74.0 | 39.5 | 15.3 | 5.6 | 1.1 |
| 100 | 96.7 | 81.7 | 52.5 | 25.2 | 10.6 | 2.2 |
| 200 | 98.4 | 89.0 | 66.7 | 38.8 | 18.3 | – |
| 400 | 99.4 | 94.6 | 79.7 | 55.4 | 31.9 | – |
| 1000 | – | 98.3 | 92.6 | 79.8 | 57.5 | 12.9 |
Tabel 1 Volumepercentage ammoniak in het evenwichtsmengsel voor de reactie
tussen stikstof en waterstof bij een scala van temperaturen en drukken.
Er wordt een breed scala van condities gebruikt, afhankelijk van de constructie van de reactor. De gebruikte temperaturen variëren tussen 600 en 700 K, en de drukken tussen 100 en 200 atmosfeer. Er wordt veel werk verricht om de effectiviteit van de katalysator te verbeteren, zodat drukken tot 50 atmosfeer kunnen worden gebruikt.
Aangezien de reactie exotherm is, worden koele reactanten (stikstof en waterstof) toegevoegd om de temperatuur van de reactoren te verlagen (figuur 3).
De ammoniak wordt gewoonlijk ter plaatse opgeslagen (stap 7) en naar een ander deel van de fabriek gepompt, waar het wordt omgezet in een meststof (ureum of een ammoniumzout). Soms wordt het echter over zee (figuur 4) of over de weg vervoerd, om in een andere fabriek te worden gebruikt.
.jpg) |
Figuur 4 In een fabriek in West-Australië wordt de ammoniak via een pijpleiding overgebracht naar een nabijgelegen haven (figuur 2, stap 8) en per schip vervoerd. Dit schip vervoert ongeveer 40 000 ton vloeibaar gemaakte ammoniak. Met vriendelijke toestemming van Yara International ASA. |
De oorspronkelijke katalysator die Haber gebruikte was Fe3O4, dat door het reagens, waterstof, werd gereduceerd tot ijzer. Er werd veel werk verricht om de katalysator te verbeteren en men ontdekte dat een kleine hoeveelheid kaliumhydroxide effectief was als promotor.
Nu is het onderzoek gericht op het vinden van nog effectievere katalysatoren om het proces bij lagere druk en temperatuur te kunnen laten plaatsvinden. Ruthenium op een grafietoppervlak is veelbelovend.
.jpg)
Figuur 5 De productie van ammoniak.
Postscript
Het Haber-proces is zo belangrijk voor ons leven dat het drie keer de Nobelprijs voor scheikunde heeft gekregen, allemaal aan Duitse wetenschappers, in een periode van bijna 90 jaar, een opmerkelijk record.
De eerste prijs werd in 1918 gegeven aan Fritz Haber, de chemicus die het proces in het laboratorium ontwikkelde. De tweede was voor Carl Bosch, wiens briljante technische vaardigheden het proces op grote schaal levensvatbaar maakten, maar die tot 1931 op zijn prijs wachtte.
In 2007 kreeg Gerhard Ertl de prijs voor zijn werk aan de katalyse van gasreacties op vaste stoffen. Onder de vele reacties die hij bestudeerde, vond hij bewijs voor de adsorptie van stikstofmoleculen en waterstofmoleculen aan het oppervlak van ijzer en dat deze geadsorbeerde moleculen uiteenvallen in atomen. Deze atomen verenigen zich vervolgens in fasen om de ammoniakmolecule te vormen. Men mag niet vergeten dat de omstandigheden die bij deze studies werden gebruikt (bij minder dan 10-10 atm) sterk verschillen van de omstandigheden die in de industrie worden gebruikt, bij ca. 150 atm.
Samenvatting
Het hele proces van de produktie van ammoniak uit methaan is samengevat in figuur 5. Als steenkool of nafta de grondstof is, zijn extra processen nodig. Nafta wordt omgezet in methaan en koolstofoxiden voordat het naar de primaire reformer gaat en vervolgens naar de verschuivingsreactie. Steenkool wordt eveneens omgezet in waterstof en koolstofoxiden en dit mengsel ondergaat vervolgens de verschuivingsreactie.