- Stel de moderne atoomtheorie op.
- Leer hoe atomen zijn opgebouwd.
Het kleinste stukje van een element dat de identiteit van dat element behoudt, wordt een atoom genoemd. Individuele atomen zijn extreem klein. Er zijn ongeveer vijftig miljoen atomen op een rij nodig om een lijn van 1 cm lang te maken. De punt aan het eind van een gedrukte zin bevat enkele miljoenen atomen. Atomen zijn zo klein dat het moeilijk te geloven is dat alle materie uit atomen bestaat – maar dat is wel zo.
Het concept dat atomen een fundamentele rol spelen in de chemie is geformaliseerd in de moderne atoomtheorie, voor het eerst verkondigd door John Dalton, een Engelse wetenschapper, in 1808. Deze bestaat uit drie delen:
- Alle materie bestaat uit atomen.
- Atomen van hetzelfde element zijn hetzelfde; atomen van verschillende elementen zijn verschillend.
- Atomen combineren in gehele getalsverhoudingen om verbindingen te vormen.
Deze concepten vormen de basis van de chemie.
Hoewel het woord atoom afkomstig is van een Grieks woord dat “ondeelbaar” betekent, begrijpen we nu dat atomen zelf zijn samengesteld uit kleinere delen die subatomaire deeltjes worden genoemd. Het eerste deel dat werd ontdekt was het elektron, een piepklein subatomair deeltje met een negatieve lading. Het wordt vaak weergegeven als e-, met het rechter superscript dat de negatieve lading aangeeft. Later werden twee grotere deeltjes ontdekt. Het proton is een massiever (maar nog steeds klein) subatomair deeltje met een positieve lading, weergegeven als p+. Het neutron is een subatomair deeltje met ongeveer dezelfde massa als een proton, maar zonder lading. Het wordt voorgesteld als n of n0. We weten nu dat alle atomen van alle elementen zijn opgebouwd uit elektronen, protonen en (op één uitzondering na) neutronen. Tabel 3.1 “Eigenschappen van de drie subatomaire deeltjes” geeft een overzicht van de eigenschappen van deze drie subatomaire deeltjes.
Tabel 3.1 Eigenschappen van de drie subatomaire deeltjes
| Naam | Symbool | Massa (ca.kg) | Lading |
|---|---|---|---|
| Proton | p+ | 1.6 × 10-27 | 1+ |
| Neutron | n, n0 | 1,6 × 10-27 | none |
| Electron | e- | 9.1 × 10-31 | 1- |
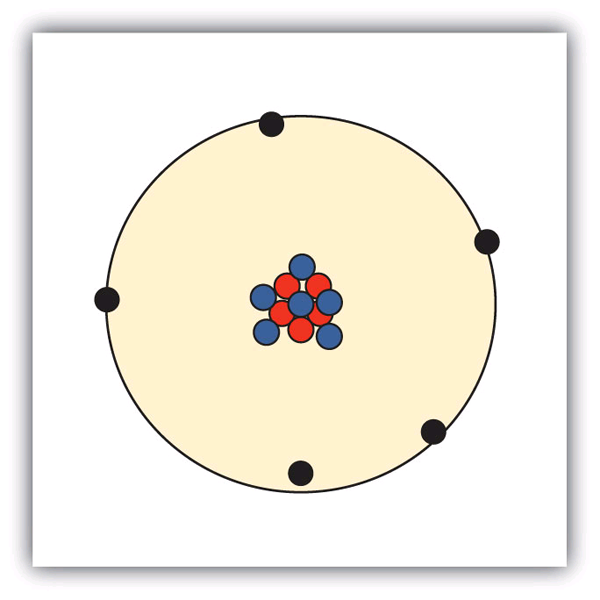
Hoe zijn deze deeltjes in atomen gerangschikt? Ze zijn niet willekeurig gerangschikt. Experimenten van Ernest Rutherford in Engeland in de jaren 1910 wezen op een nucleair model van het atoom. De relatief massieve protonen en neutronen zijn verzameld in het centrum van een atoom, in een gebied dat de atoomkern wordt genoemd (meervoud kernen). De elektronen bevinden zich buiten de atoomkern en draaien in de ruimte om de atoomkern heen. (Zie figuur 3.1 “De structuur van het atoom”.)
Figuur 3.1 De structuur van het atoom
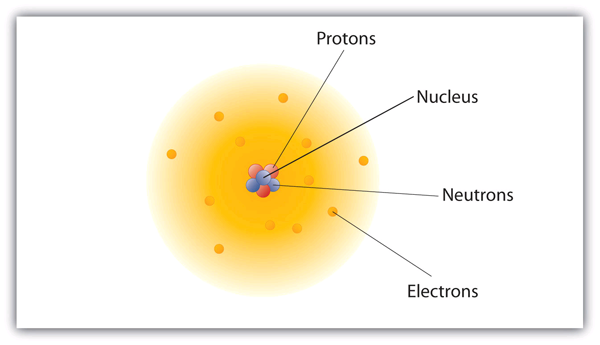
Atomen hebben protonen en neutronen in het centrum, die de kern vormen, terwijl de elektronen om de kern heen draaien.
De moderne atoomtheorie stelt dat atomen van één element hetzelfde zijn, terwijl atomen van verschillende elementen verschillend zijn. Wat maakt atomen van verschillende elementen verschillend? Het fundamentele kenmerk dat alle atomen van eenzelfde element delen is het aantal protonen. Alle waterstofatomen hebben één en slechts één proton in de kern; alle ijzeratomen hebben 26 protonen in de kern. Dit aantal protonen is zo belangrijk voor de identiteit van een atoom dat het het atoomnummer van het element wordt genoemd. Zo heeft waterstof een atoomnummer van 1, terwijl ijzer een atoomnummer van 26 heeft. Elk element heeft zijn eigen karakteristieke atoomnummer.
Atomen van hetzelfde element kunnen echter verschillende aantallen neutronen hebben. Atomen van hetzelfde element (d.w.z. atomen met hetzelfde aantal protonen) met een verschillend aantal neutronen worden isotopen genoemd. De meeste natuurlijk voorkomende elementen bestaan als isotopen. Zo hebben de meeste waterstofatomen één enkel proton in hun kern. Een klein aantal (ongeveer één op een miljoen) waterstofatomen heeft echter een proton en een neutron in zijn kern. Deze bijzondere isotoop van waterstof wordt deuterium genoemd. Een zeer zeldzame vorm van waterstof heeft één proton en twee neutronen in de kern; deze isotoop van waterstof wordt tritium genoemd. De som van het aantal protonen en neutronen in de kern wordt het massagetal van de isotoop genoemd.
Neutrale atomen hebben evenveel elektronen als ze protonen hebben, dus hun totale lading is nul. Maar, zoals we later zullen zien, is dat niet altijd het geval.
Voorbeeld 1
- De meest voorkomende koolstofatomen hebben zes protonen en zes neutronen in hun kern. Wat zijn het atoomnummer en het massagetal van deze koolstofatomen?
- Een isotoop van uranium heeft een atoomnummer van 92 en een massagetal van 235. Wat is het aantal protonen en neutronen in de kern van dit atoom?
Oplossing
- Als een koolstofatoom zes protonen in de kern heeft, dan is het atoomnummer 6. Als het ook zes neutronen in de kern heeft, dan is het massagetal 6 + 6, ofwel 12.
- Als het atoomnummer van uranium 92 is, dan is dat ook het aantal protonen in de kern. Omdat het massagetal 235 is, dan is het aantal neutronen in de kern 235 – 92, ofwel 143.
Test jezelf
Het aantal protonen in de kern van een tinatoom is 50, terwijl het aantal neutronen in de kern 68 is. Wat zijn het atoomnummer en het massagetal van deze isotoop?
Antwoord
Atoomnummer = 50, massagetal = 118
Wanneer we het over een atoom hebben, gebruiken we gewoon de naam van het element: de term natrium verwijst zowel naar het element als naar een atoom natrium. Maar het kan onhandig zijn om steeds de naam van een element te gebruiken. In plaats daarvan definieert de scheikunde een symbool voor elk element. Het atoomsymbool is een afkorting van één of twee letters van de naam van het element. Het is gebruikelijk dat de eerste letter van het symbool van een element altijd een hoofdletter is, terwijl de tweede letter (indien aanwezig) een kleine letter is. Het symbool voor waterstof is dus H, het symbool voor natrium is Na, en het symbool voor nikkel is Ni. De meeste symbolen komen uit de Engelse naam van het element, hoewel sommige symbolen uit de Latijnse naam van een element komen. (Het symbool voor natrium, Na, komt van zijn Latijnse naam, natrium.) In tabel 3.2 “Namen en symbolen van veelvoorkomende elementen” staan enkele veelvoorkomende elementen en hun symbolen. Je moet de symbolen in tabel 3.2 “Namen en symbolen van gewone elementen” uit je hoofd leren, omdat dit de manier is waarop we elementen in de scheikunde zullen voorstellen.
Tabel 3.2 Namen en symbolen van veelvoorkomende elementen
Element NameSymbol
| Element Naam | Symbool | |||
|---|---|---|---|---|
| Aluminium | Al | Mercury | Hg | |
| Ar | Molybdeen | Mo | ||
| As | Neon | Ne | ||
| Barium | Ba | Nikkel | Ni | |
| Be | Nitrogen | N | ||
| Bi | Zuurstof | O | ||
| B | Palladium | Pd | ||
| Br | Fosfor | P | ||
| Ca | Platinum | Pt | ||
| Koolstof | C | Kalium | K | |
| Chloor | Cl | Radium | Ra | |
| Chromium | Cr | Radon | Rn | |
| Cobalt | Co | Rubidium | Rb | |
| Koper | Cu | Scandium | Sc | |
| F | Selenium | Se | ||
| Gallium | Ga | Silicium | Si | |
| Ge | Zilver | Ag | ||
| Au | Natrium | Na | ||
| Helium | He | Strontium | Sr | |
| Waterstof | H | Zwavel | S | |
| I | Tantaal | Ta | ||
| Iridium | Ir | Tin | Sn | |
| Iron | Fe | Titanium | Ti | |
| Krypton | Kr | Tungsten | W | |
| Lood | Pb | Uranium | U | |
| Lithium | Li | Xenon | Xe | |
| Mg | Zink | Zn | ||
| Mn | Zirkonium | Zr |
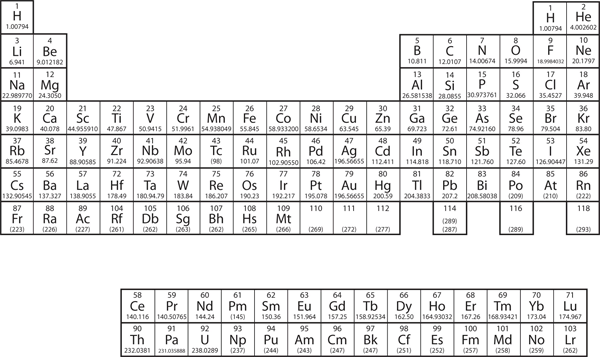
De elementen zijn gegroepeerd in een speciale tabel die het periodiek systeem wordt genoemd. Een eenvoudig periodiek systeem is afgebeeld in figuur 3.2 “Een eenvoudig periodiek systeem”, terwijl een meer uitgebreid systeem wordt gepresenteerd in hoofdstuk 17 “Appendix: Periodiek systeem der elementen”. De elementen in het periodiek systeem zijn gerangschikt in oplopende volgorde van atoomnummer. Het periodiek systeem heeft een speciale vorm die voor ons van belang zal worden wanneer we de organisatie van elektronen in atomen zullen beschouwen (zie hoofdstuk 8 “Elektronische structuur”). Een direct gebruik van het periodiek systeem helpt ons metalen en niet-metalen te identificeren. De niet-metalen bevinden zich in de rechterbovenhoek van het periodiek systeem, aan één kant van de zware lijn die het rechterdeel van de tabel splitst. Alle andere elementen zijn metalen.
Figuur 3.2 Een eenvoudig periodiek systeem
Er is een eenvoudige manier om isotopen weer te geven met behulp van de atoomsymbolen. We gebruiken de constructie
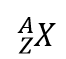
waarbij X het symbool van het element is, A het massagetal, en Z het atoomnummer. Voor de isotoop koolstof met 6 protonen en 6 neutronen is het symbool dus
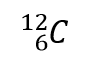
waar C het symbool is voor het element, 6 staat voor het atoomnummer, en 12 staat voor het massagetal.
Voorbeeld 2
- Wat is het symbool voor een isotoop van uranium dat een atoomnummer van 92 en een massagetal van 235 heeft?
- Hoeveel protonen en neutronen zitten er in 26Fe?
Oplossing
- Het symbool voor deze isotoop is
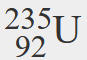
- Dit ijzeratoom heeft 26 protonen en 56 – 26 = 30 neutronen.
Test jezelf
Hoeveel protonen zitten er in 11N?
Antwoord
11 protonen
Het is ook gebruikelijk om het massagetal achter de naam van een element te vermelden om een bepaalde isotoop aan te duiden. Koolstof-12 is een isotoop van koolstof met 6 protonen en 6 neutronen, terwijl uranium-238 een isotoop van uranium is met 146 neutronen.
Key Takeaways
- De scheikunde is gebaseerd op de moderne atoomtheorie, die stelt dat alle materie uit atomen bestaat.
- De atomen zelf zijn opgebouwd uit protonen, neutronen en elektronen.
- Elk element heeft zijn eigen atoomnummer, dat gelijk is aan het aantal protonen in zijn kern.
- Isotopen van een element bevatten verschillende aantallen neutronen.
- Elementen worden voorgesteld door een atoomsymbool.
- Het periodiek systeem is een tabel waarin alle elementen zijn geordend.
Oefeningen
Lijst de drie stellingen die samen de moderne atoomtheorie vormen.
Uitleg hoe atomen zijn opgebouwd.
Welke is groter, een proton of een elektron?
Welke is groter, een neutron of een elektron?
Wat zijn de ladingen van elk van de drie subatomaire deeltjes?
Waar bevindt zich het grootste deel van de massa van een atoom?
Schets een diagram van een boriumatoom, dat vijf protonen en zes neutronen in zijn kern heeft.
Schets een diagram van een heliumatoom, dat twee protonen en twee neutronen in zijn kern heeft.
Definieer atoomnummer. Wat is het atoomnummer van een booratoom?
Wat is het atoomnummer van helium?
Definieer isotoop en geef een voorbeeld.
Wat is het verschil tussen deuterium en tritium?
Welk paar vertegenwoordigt isotopen?
a) ![]()
b) 26F en 25M
c) 14S en 15P
14. Welk paar stelt isotopen voor?
a) 20C en 19K
b) 26F en 26F
c) 92U en 92U
15. Geef van elk atoom de volledige symbolen, inclusief het atoomnummer en het massagetal.
a) een zuurstofatoom met 8 protonen en 8 neutronen
b) een kaliumatoom met 19 protonen en 20 neutronen
c) een lithiumatoom met 3 protonen en 4 neutronen
16. Geef volledige symbolen van elk atoom, inclusief het atoomnummer en het massagetal.
a) een magnesiumatoom met 12 protonen en 12 neutronen
b) een magnesiumatoom met 12 protonen en 13 neutronen
c) een xenonatoom met 54 protonen en 77 neutronen
17. Americium-241 is een isotoop die wordt gebruikt in rookmelders. Wat is het volledige symbool voor deze isotoop?
18. Koolstof-14 is een isotoop die wordt gebruikt om radioactieve dateringstests uit te voeren op eerder levend materiaal. Wat is het volledige symbool voor deze isotoop?
19. Geef atoomsymbolen voor elk element.
a) natrium
b) argon
c) stikstof
d) radon
20. Geef atoomsymbolen voor elk element.
a) zilver
b) goud
c) kwik
d) jodium
21. Geef de naam van het element.
a) Si
b) Mn
c) Fe
d) Cr
22. Geef de naam van het element.
a) F
b) Cl
c) Br
d) I
Alle materie is opgebouwd uit atomen; atomen van hetzelfde element zijn hetzelfde, en atomen van verschillende elementen zijn verschillend; atomen combineren in gehele getalsverhoudingen om verbindingen te vormen.
Een proton is groter dan een elektron.
proton: 1+; elektron: 1-; neutron: 0
Het atoomnummer is het aantal protonen in een kern. Borium heeft een atoomnummer van vijf.
Isotopen zijn atomen van hetzelfde element, maar met een verschillend aantal neutronen. 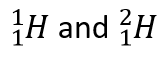 zijn voorbeelden.
zijn voorbeelden.
a) isotopen
b) geen isotopen
c) geen isotopen
a) ![]()
b) 19K
c) ![]()
95A
a) Na
b) Ar
c) N
d) Rn
a) silicium
b) mangaan
c) ijzer
d) chroom