Alle zouten en ionen die in zeewater oplossen, dragen bij tot de totale zoutheid van dat water. Het zoutgehalte van zeewater wordt meestal uitgedrukt in grammen zout per kilogram (1000 g) zeewater. Gemiddeld is ongeveer 35 g zout aanwezig in elke 1 kg zeewater, dus zeggen we dat het gemiddelde zoutgehalte van de oceaan 35 delen per duizend (ppt) is. Merk op dat 35 ppt gelijk is aan 3,5% (delen per honderd). Sommige bronnen gebruiken nu praktische saliniteitseenheden (PSU) om de saliniteitswaarden uit te drukken, waarbij 1 PSU = 1 ppt. De eenheden zijn niet opgenomen, zodat we gewoon kunnen verwijzen naar een zoutgehalte van 35.
Er zijn veel verschillende stoffen opgelost in de oceaan, maar zes ionen omvatten ongeveer 99,4% van alle opgeloste ionen in zeewater. Deze zes belangrijkste ionen zijn (tabel 5.3.1):
Tabel 5.3.1 De zes belangrijkste ionen in zeewater
| g/kg in zeewater | % ionen per gewicht | |
|---|---|---|
| Chloride Cl- | 19.35 | 55,07% |
| 10,76 | 30,6% | |
| Sulfaat SO42- | 2,71 | 7.72% |
| 1,29 | 3,68% | |
| 0,41 | 1,17% | |
| Kalium K+ | 0,39 | 1,1% | Kalcium Ca2+ | 0,41 | 1,17% | Potassium K+ | 0,39 | 1.1% |
| 99,36% |
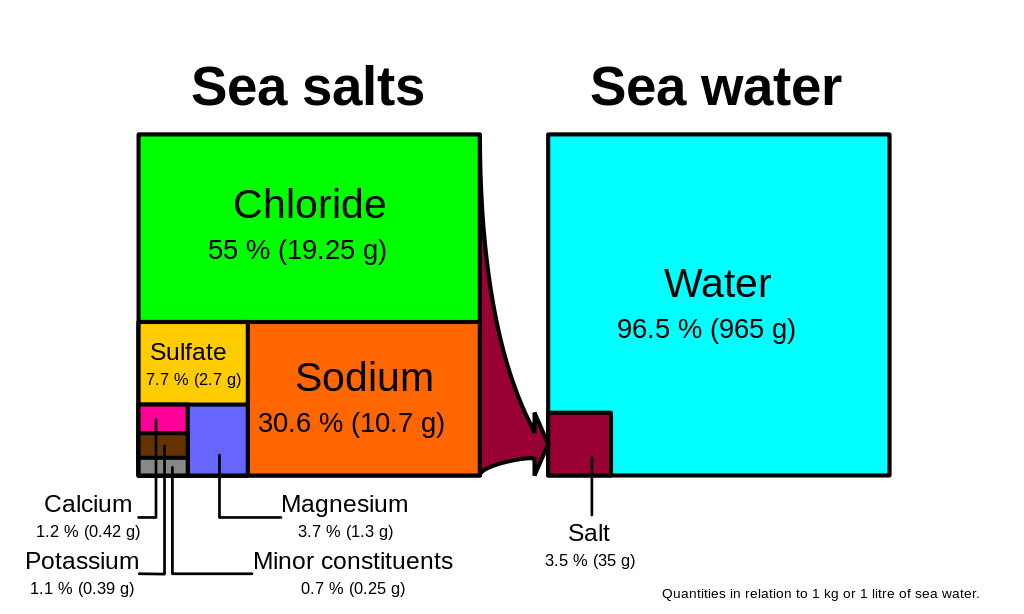
Chloride en natrium, de bestanddelen van keukenzout (natriumchloride NaCl), maken meer dan 85% uit van de ionen in de oceaan, en daarom smaakt zeewater zout (figuur 5.3.1). Naast de hoofdbestanddelen zijn er talrijke minder belangrijke bestanddelen: radionucleotiden, organische verbindingen, metalen, enz. Deze minder belangrijke bestanddelen worden aangetroffen in concentraties van ppm (parts per million) of ppb (parts per billion), in tegenstelling tot de grote ionen die veel talrijker zijn (ppt) (tabel 5.3.2). Om dit in perspectief te plaatsen: 1 ppm = 1 mg/kg, of het equivalent van 1 theelepel suiker opgelost in 14.000 blikjes frisdrank. 1 ppb = 1 μg/kg, of het equivalent van 1 theelepel van een stof opgelost in vijf Olympische zwembaden! Deze minder belangrijke bestanddelen vertegenwoordigen talrijke stoffen, maar samen maken zij minder dan 1% uit van de ionen in het zeewater. Sommige van deze stoffen kunnen belangrijk zijn als mineralen en sporenelementen die van vitaal belang zijn voor levende organismen, maar zij hebben niet veel invloed op het totale zoutgehalte. Maar gezien de enorme omvang van de oceanen kunnen zelfs materialen die in sporenrijkdom worden aangetroffen, vrij grote reservoirs vormen. Goud bijvoorbeeld is een spoorelement in zeewater, dat wordt aangetroffen in concentraties van delen per triljoen, maar als je al het goud in slechts één km3 zeewater zou kunnen winnen, zou dat ongeveer 20 miljoen dollar waard zijn!2 Concentraties van enkele minder belangrijke elementen in zeewater
| g/kg in zeewater | g/kg in zeewater | ||
|---|---|---|---|
| Koolstof | 0.028 | Iron | 2 x 10-6 |
| 0,0115 | Mangaan | 2 x 10-7 | |
| 0.006 | Koper | 1 x 10-7 | Silicium | 0.002 | Mercury | 3 x 10-8 |
| Phosphorous | 6 x 10-5 | Gold | 4 x 10-9 |
| Uranium | 3.2 x 10-6 | Lood | 5 x 10-10 |
| Aluminium | 2 x 10-6 | Radon | 6 x 10-19 |
Omdat de zes grote ionen in zeewater meer dan 99% van het totale zoutgehalte uitmaken, hebben veranderingen in de abundantie van de minder belangrijke bestanddelen weinig effect op het totale zoutgehalte. Bovendien stelt de regel van constante verhoudingen dat, hoewel het absolute zoutgehalte van oceaanwater op verschillende plaatsen kan verschillen, de relatieve verhoudingen van de zes hoofdionen in dat water altijd constant zijn. Zo zal, ongeacht het totale zoutgehalte van een zeewatermonster, 55% van het totale zoutgehalte toe te schrijven zijn aan chloride, 30% aan natrium, enzovoort. Omdat de verhouding van deze hoofdionen niet verandert, noemen we ze conservatieve ionen.
Gezien deze constante verhoudingen, kan men om het totale zoutgehalte te berekenen eenvoudigweg de concentratie van één van de hoofdionen meten en die waarde gebruiken om de rest te berekenen. Traditioneel is chloride het ion dat wordt gemeten omdat het het meest voorkomt en dus het eenvoudigst nauwkeurig te meten is. Vermenigvuldiging van de chlorideconcentratie met 1,8 geeft het totale zoutgehalte. Bijvoorbeeld, in figuur 5.3.1: 19,25 g/kg (ppt) chloride x 1,8 = 35 ppt. Voor snelle metingen van het zoutgehalte wordt tegenwoordig vaak de elektrische geleidbaarheid gebruikt in plaats van de bepaling van de chlorideconcentratie (zie onderstaand kader).

Dit instrument meet de mate van buiging, of breking, van lichtstralen als ze door een vloeistof gaan. Hoe groter de hoeveelheid opgeloste zouten in het monster, hoe groter de mate van lichtbreking. De waarnemer vangt een druppel water op het blauwe scherm en kijkt door het oculair. De scheidingslijn tussen het blauwe en het witte deel van de schaal (inzet) kan worden gebruikt om het zoutgehalte af te lezen.
Voor nauwkeuriger metingen gebruiken de meeste oceanografen een instrument dat de elektrische geleidbaarheid meet. Er wordt een elektrische stroom geleid tussen twee elektroden die in water zijn ondergedompeld, en hoe hoger het zoutgehalte, hoe gemakkelijker de stroom zal worden geleid (de ionen in zeewater geleiden elektrische stromen). Geleidbaarheidssondes worden vaak gebundeld in een instrument dat CTD wordt genoemd, wat staat voor Conductivity, Temperature, and Depth (geleidbaarheid, temperatuur en diepte); dit zijn de meest gemeten parameters. Moderne CTD’s kunnen worden uitgerust met een reeks sondes die parameters als licht, troebelheid (helderheid van het water), opgeloste gassen enz. meten. CTD’s kunnen grote instrumenten zijn (zie hieronder), maar er zijn ook kleine handheld zoutgehalte-sondes verkrijgbaar.

Voor grootschalige metingen van het zoutgehalte kunnen oceanografen satellieten gebruiken, zoals de Aquarius-satelliet, die verschillen in zoutgehalte aan het oppervlak kon meten van slechts 0,2 PSU door het oceaanoppervlak om de zeven dagen in kaart te brengen (hieronder).
Het is belangrijk te beseffen dat, hoewel de regel van constante verhoudingen voor het grootste deel van de oceaan geldt, er bepaalde kustgebieden kunnen zijn waar veel rivierafvoer deze verhoudingen enigszins kan veranderen. Verder is het belangrijk om te onthouden dat de regel van constante verhoudingen alleen geldt voor de hoofdionen. De verhoudingen van de kleinere ionen kunnen schommelen, maar vergeet niet dat zij slechts een zeer kleine bijdrage leveren aan het totale zoutgehalte. Omdat de concentraties van de kleinere ionen niet constant zijn, worden deze aangeduid als niet-conservatieve ionen.
Waarom worden de grote ionen in constante verhoudingen aangetroffen? Er is een constante aanvoer van ionen door de afvloeiing van rivieren en andere processen, meestal in verhoudingen die sterk verschillen van wat er in de oceaan wordt aangetroffen. Waarom veranderen de verhoudingen in de oceanen dan niet? De meeste ionen die door rivieren worden afgevoerd hebben een vrij korte verblijftijd (zie paragraaf 5.2) vergeleken met ionen in zeewater, meestal omdat ze worden gebruikt in biologische processen. Door deze lage verblijftijden kunnen de ionen zich niet ophopen en het zoutgehalte veranderen. Bovendien bedraagt de mengingstijd van de wereldoceaan ongeveer 1000 jaar, wat zeer kort is vergeleken met de verblijftijden van de belangrijkste ionen, die tientallen miljoenen jaren kunnen bedragen. Dus gedurende de verblijftijd van een enkel ion heeft de oceaan zich vele malen gemengd, en zijn de hoofdionen gelijkmatig over de oceaan verdeeld.
Variaties in saliniteit
De totale saliniteit in de open oceaan is gemiddeld 33-37 ppt, maar kan op verschillende plaatsen aanzienlijk variëren. Maar aangezien de verhoudingen tussen de belangrijkste ionen constant zijn, moeten de regionale verschillen in saliniteit eerder te wijten zijn aan de aanvoer en afvoer van water dan aan de toevoeging of verwijdering van ionen. Zoet water wordt aangevoerd via processen als neerslag, afvloeiing van land en smeltend ijs. De verwijdering van zoet water vindt hoofdzakelijk plaats door verdamping en bevriezing (wanneer zeewater bevriest, bestaat het resulterende ijs grotendeels uit zoet water en worden de zouten uitgesloten, waardoor het resterende water nog zouter wordt). Verschillen in neerslaghoeveelheden, verdamping, rivierafvoer en ijsvorming spelen dus een belangrijke rol in de regionale verschillen in zoutgehalte. De Oostzee bijvoorbeeld heeft een zeer laag zoutgehalte van ongeveer 10 ppt aan het oppervlak, omdat het een grotendeels ingesloten watermassa is met veel rivieraanvoer. De Rode Zee daarentegen is zeer zout (ongeveer 40 ppt), als gevolg van het gebrek aan neerslag en de hete omgeving die tot veel verdamping leidt.
Een van de zoutste grote waterlichamen op aarde is de Dode Zee, tussen Israël en Jordanië. Het zoutgehalte in de Dode Zee is ongeveer 330 ppt, dat is bijna tien keer zouter dan in de oceaan. Dit extreem hoge zoutgehalte is een gevolg van de hete, dorre omstandigheden in het Midden-Oosten die leiden tot hoge verdampingsnelheden. Bovendien werd in de jaren 1950 het debiet van de Jordaan weggeleid van de Dode Zee, zodat er niet langer een significante toevoer van zoet water is. Nu er geen water meer wordt aangevoerd en er veel verdampt, daalt het waterpeil in de Dode Zee met ongeveer 1 m per jaar. Het hoge zoutgehalte maakt het water zeer dicht, waardoor drijfkrachten ontstaan die ervoor zorgen dat mensen gemakkelijk aan de oppervlakte kunnen blijven drijven. Maar het hoge zoutgehalte betekent ook dat het water te zout is voor de meeste levende organismen, zodat alleen microben zich er kunnen vestigen; vandaar de naam Dode Zee. Maar hoe zout de Dode Zee ook mag zijn, het is niet het zoutste waterlichaam op aarde. Dat is Gaet’ale Pond in Ethiopië, met een zoutgehalte van 433 ppt!
Litudinale variaties
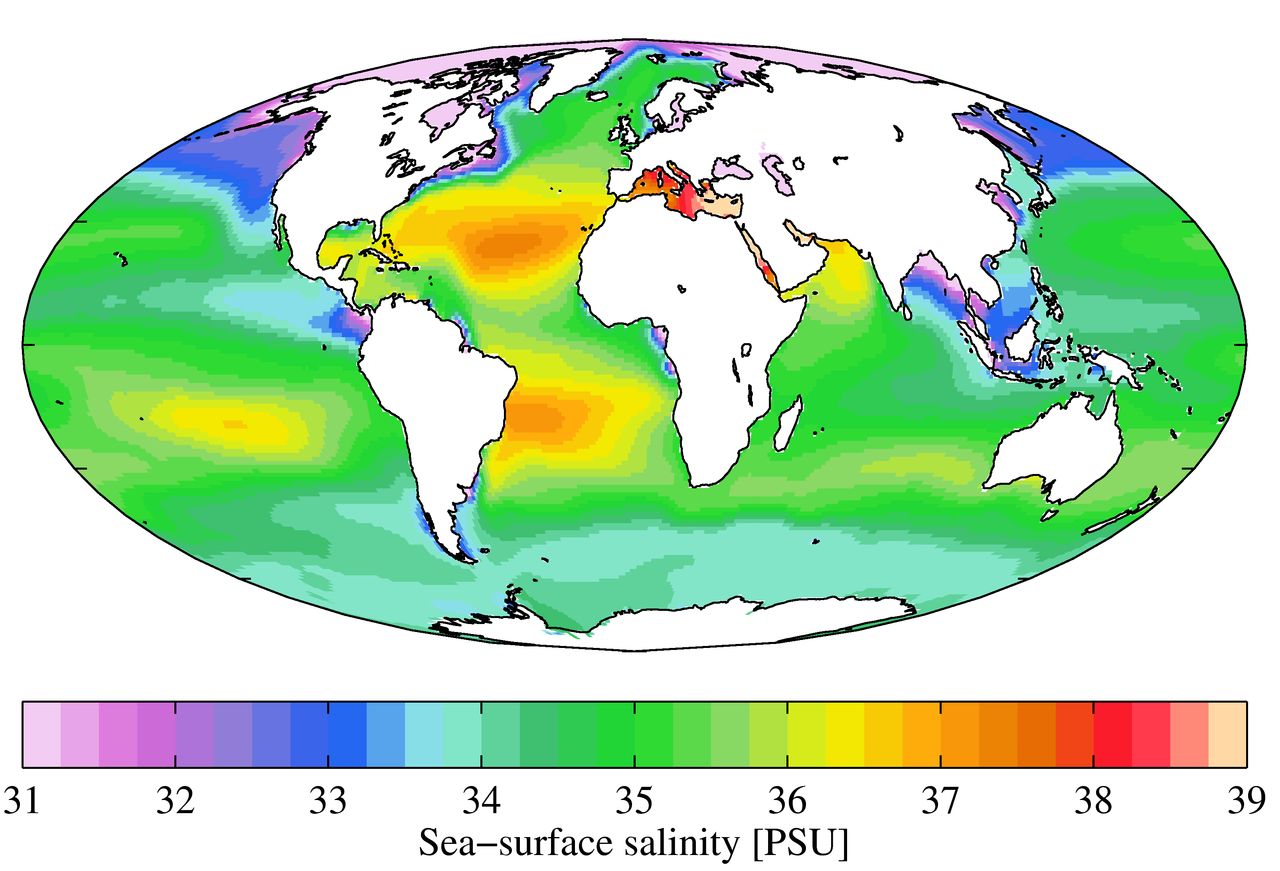
Weliswaar zijn lokale omstandigheden belangrijk voor het bepalen van zoutpatronen op een bepaalde plaats, maar er zijn enkele globale patronen die nader onderzoek verdienen. De temperatuur is het hoogst aan de evenaar en het laagst nabij de polen, zodat we een hogere verdamping en dus een hoger zoutgehalte zouden verwachten in equatoriale gebieden (figuur 5.3.2). Dit is over het algemeen het geval, maar in de onderstaande figuur lijkt het zoutgehalte vlak langs de evenaar iets lager te zijn dan op iets hogere breedtegraden. Dit komt doordat in de equatoriale gebieden ook regelmatig veel regen valt, waardoor het oppervlaktewater langs de evenaar wordt verdund. De hogere zoutgehalten worden dus aangetroffen op subtropische, warme breedtegraden met een hoge verdamping en minder neerslag. Aan de polen is er weinig verdamping, wat, in combinatie met het smelten van ijs en sneeuw, een relatief laag zoutgehalte aan het oppervlak oplevert. De afbeelding hieronder toont het hoge zoutgehalte in de Middellandse Zee; deze bevindt zich in een warme regio met hoge verdamping, en de zee is grotendeels geïsoleerd van vermenging met de rest van het Noord-Atlantische water, wat leidt tot het hoge zoutgehalte. Lagere zoutgehalten, zoals rond Zuidoost-Azië, zijn het gevolg van neerslag en grote hoeveelheden rivieraanvoer.
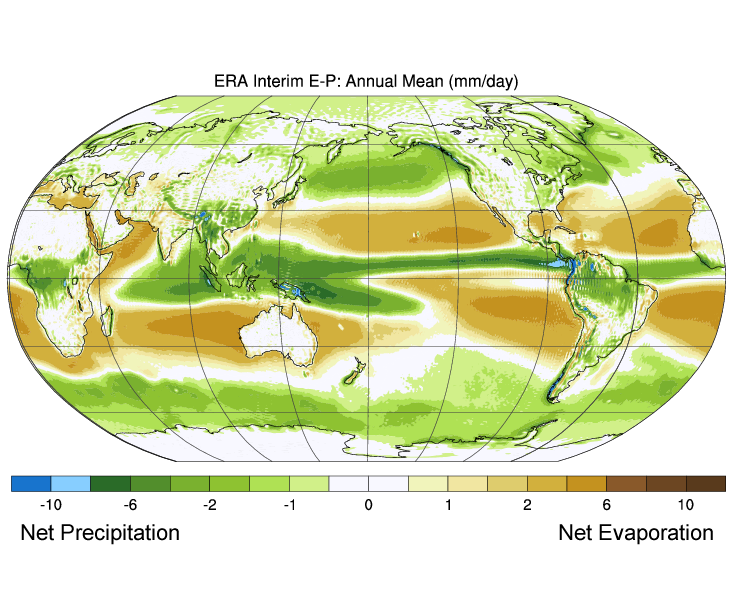
Figuur 5.3.3 toont de gemiddelde wereldwijde verschillen tussen verdamping en neerslag (verdamping – neerslag). De groene kleuren geven gebieden aan waar de neerslag groter is dan de verdamping, terwijl de bruine regio’s gebieden zijn waar de verdamping groter is dan de neerslag. Let op de correlatie tussen neerslag, verdamping en zoutgehalte aan het oppervlak, zoals te zien in figuur 5.3.2.
Verticale variatie
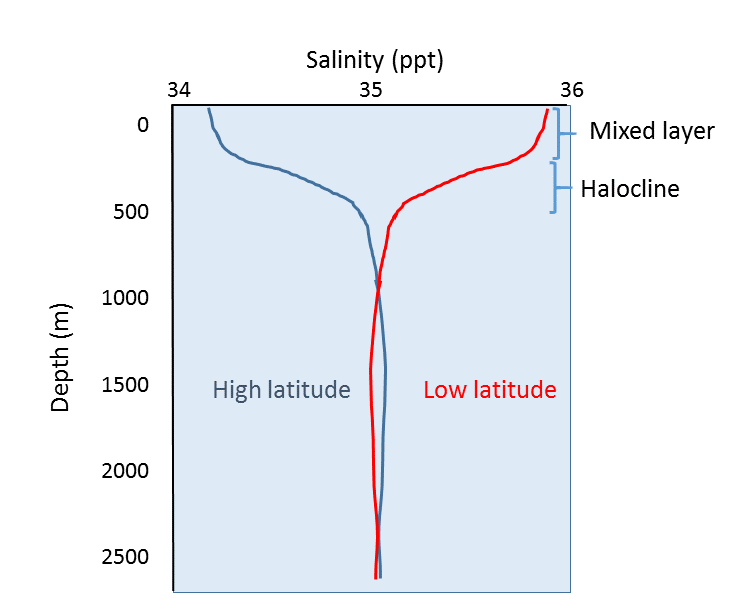
Naast geografische variatie in saliniteit, zijn er ook veranderingen in saliniteit met de diepte. Zoals we hebben gezien, zijn de meeste verschillen in saliniteit het gevolg van variaties in verdamping, neerslag, afvloeiing en ijsbedekking. Al deze processen vinden plaats aan het oppervlak van de oceaan, niet op diepte, zodat de meest uitgesproken verschillen in saliniteit te vinden zijn in oppervlaktewateren. De saliniteit in dieper water blijft betrekkelijk uniform, aangezien deze niet door deze oppervlakteprocessen wordt beïnvloed. Enkele representatieve saliniteitsprofielen zijn weergegeven in figuur 5.3.4. Aan de oppervlakte vertoont de bovenste 200 m ongeveer een relatief uniform zoutgehalte in wat de gemengde laag wordt genoemd. Winden, golven en oppervlaktestromingen brengen het oppervlaktewater in beroering, waardoor in deze laag veel menging optreedt en het zoutgehalte vrij uniform is. Onder de gemengde laag bevindt zich een zone met snelle veranderingen in saliniteit bij een kleine verandering in diepte. Deze zone van snelle verandering wordt de halocline genoemd en vormt de overgang tussen de gemengde laag en de diepe oceaan. Onder de halocline kan de saliniteit tot op de zeebodem weinig variatie vertonen, omdat dit gebied ver verwijderd is van de oppervlakteprocessen die de saliniteit beïnvloeden. In de onderstaande figuur is te zien dat het zoutgehalte aan de oppervlakte laag is op hoge breedtegraden, en hoger op lage breedtegraden, zoals hierboven besproken.
een atoom of molecuul dat elektronen heeft gewonnen of verloren en daardoor geladen is geworden (5.1)
de concentratie van opgeloste ionen in water (5.3)
eenheidsloze maat voor het zoutgehalte, gelijk aan delen per duizend (5.3)
de zes ionen die samen meer dan 99% van de ionen in de oceaan vormen (chloride, natrium, sulfaat, magnesium, calcium, kalium) (5.3)
de belangrijkste ionen in zeewater worden altijd in dezelfde verhoudingen aangetroffen, ongeacht het totale zoutgehalte (5.3)
de belangrijkste ionen in zeewater (5.3)
de belangrijkste ionen in zeewater waarvan de verhoudingen schommelen naarmate het zoutgehalte verandert (5.
de stroom van water langs een helling, hetzij over het grondoppervlak, hetzij binnen een reeks kanalen (12.2)
de gemiddelde tijd dat een element in de oceaan blijft voordat het wordt verwijderd (5.2)
deeltjes per duizend
de afstand ten noorden of ten zuiden van de evenaar, gemeten als een hoek vanaf de evenaar (2.
de bovenste laag van de oceaan, waar winden, golven en stromingen het water mengen zodat de omstandigheden relatief constant zijn; ongeveer de bovenste 100 m (5.3)
waar er een dramatische verandering in zoutgehalte is bij een kleine verandering in diepte (5.3)