Kaneelzuur Chemische Eigenschappen,Toepassingen,Productie
Chemische Eigenschappen
Kaneelzuur bestaat in cis- en trans-vormen. het stabielere isomeer is het trans-isomeer, dat van nature voorkomt en het gebruikelijke handelsproduct is. Het verschijnt als witte monokliene prisma’s met een licht kaneelaroma. Het is oplosbaar in ethanol, methanol, petroleumether en chloroform; het is gemakkelijk oplosbaar in benzeen, ether, aceton, azijnzuur, koolstofdisulfide en oliën, maar onoplosbaar in water.
Kaneelzuur werd voor het eerst geïsoleerd als kristallen uit kaneelolie door Trommsdorf in 1780. Hij dacht dat het benzoëzuur was. Dumas en Peligot ´ identificeerden het in 1835, en in 1856 slaagde Bertagnini erin het te synthetiseren uit benzaldehyde en acetylchloride.
Kaneelzuur ondergaat reacties die typisch zijn voor een carboxylgroep en een olefinische dubbele binding. De carboxylgroep kan worden veresterd om cinnamaten te vormen, waarvan sommige belangrijke smaak- en geurstoffen zijn. Bij reactie met anorganische zuurchloriden, zoals thionylchloride of fosforchloriden, ontstaat kaneelzuur cinnamoylchloride. Bij verhitting vormt kaneelzuur styreen en kooldioxide. Met oxidatiemiddelen of bij verhitting met alkali, splitst de olefinische dubbele binding om benzaldehyde te geven.
Fysische en Chemische Eigenschappen
Kaneelzuur, ook bekend als benzalacetaat, 3-fenyl-2-propeenzuur, behoort tot een soort onverzadigd aromatisch zuur met een lichte kaneelgeur. Het komt voor in balsem, kaneelolie en cocablad in vrije vorm of in de vorm van een ester. Door de aanwezigheid van een dubbele binding heeft kaneelzuur trans- cis-twee isomeren, waarbij de cis-vorm nog eens drie soorten homogene polykristallijn bevat. Zowel de trans-vorm als de cis-vorm komen voor in de natuur. De trans-vorm komt voor in de aanwezigheid van etherische oliën, waaronder storax, kaneelolie, Peruaanse balsem, basilicumolie en cacaobladeren. De cis-vorm komt voor in galangalolie uit Malakka, waarbij de trans-vorm stabieler is dan de cis-vorm. De in de handel verkrijgbare producten zijn meestal in de trans-vorm. Het heeft een relatieve molecuulmassa van 148,17. De eerste kristallijne vorm van de cis-vorm wordt allocinnaminezuur genoemd, waarbij de uit water neergeslagen verbinding monoklien is. Het zijn kleurloze tot witte prismatische kristallen met een relatieve dichtheid van 1,284 (4 ℃), een smeltpunt van 42 ℃, een kookpunt van 265 ℃ (ontleding) en 125 ℃ (2,533 × 103Pa); het is slecht oplosbaar in water (25 ℃ bij 0,937), maar goed oplosbaar in alcohol, ether en ethylacetaat.De tweede polymorf wordt alfa-iso-cinnamzuur genoemd, waarbij de uit ligroïne neergeslagen verbinding het monokliene kristal is. Het zijn kleurloze tot witte prismatische kristallen met een mp van 58 ℃ en een kookpunt van 265 ℃. Het is oplosbaar in ethanol, azijnzuur, chloroform en aceton en gemakkelijk oplosbaar in ether. De derde polymorf heet bèta-iso-cinnamaatzuur; het verschijnt als monokliene kleurloze tot witte prismatische kristallen met een mp van 68 ℃. Het is oplosbaar in alcohol, ether, azijnzuur, chloroform en aceton. Trans-isomeer neergeslagen uit verdunde ethanol behoort tot de monokliene kristallen en verschijnt als witte tot lichtgele prismatische kristallen met de relatieve dichtheid is 1.2475 (4 ℃), smeltpunt is 133 ℃ en het kookpunt is 300 ℃. Het is zeer slecht oplosbaar in water (25 ℃: 0.1; 98 ℃: 0.588), oplosbaar in ethanol (25 ℃: 23), chloroform (15 ℃: 5.9), gemakkelijk oplosbaar in benzeen, ether, aceton, azijnzuur en koolstofdisulfide. Gedestilleerd bij 140 ℃ wordt het gedecarboxyleerd tot styreen (Styrax BP). Bij oxidatie ontstaat benzoëzuur. Zowel de cis- als de trans-isomeer hebben een bloemenhoningaroma met een zoete en kruidige smaak. LD50 bij ratten: 2500 mg/kg.
Rol en doel
Kaneelzuur is een belangrijke soort organische synthetische grondstof. Het wordt hoofdzakelijk gebruikt voor de synthese van methylcinnamaat, ethylcinnamaat en kaneelzuurbenzylester. Het wordt veel gebruikt in de parfumindustrie en de farmaceutische industrie. In de geneeskunde is het ooit gebruikt als insectenwerend middel.
Kaneelzuur werd gebruikt als specerij voor de bereiding van kersen-, abrikozen-, honing- en kaneelaroma’s en -aroma’s; het kan ook worden gebruikt als uitgangsmateriaal van kaneelzuurester. De GB2760-1996 van ons land bepaalde dat kaneelzuur is toegestaan eetbare specerijen; bovendien kan het ook worden gebruikt als grondstof van fotogevoelige hars poly vinyl kaneelzuur serie; het kan ook worden gebruikt als grondstof voor de synthese van methyl-, ethyl- en benzylesters. Deze esters, die als geurstoffen worden gebruikt, kunnen worden toegepast in cosmetica en zeep, het kan ook worden gebruikt als plaatselijke verdoving, hemostatische middelen en farmaceutische produkten (melkzuur Prenylamine en baclofen, enz.) grondstoffen; kan kaneelzuur ook worden gebruikt als plantengroeiregulatoren en grondstoffen voor pesticiden; anticorrosiemiddelen voor fruit en groenten; grondstof van ultraviolette agent en lichtgevoelige hars voor cosmetische zonnebrandmiddelen. Kaneelzuur kan ook worden gebruikt als de standaard voor organische sporenanalyse en bepaling van dubbele binding, bepaling van uranium en vanadium en thorium scheiding.
Toepassingen
Kaneelzuur is een belangrijk tussenproduct bij de bereiding van zijn esters, die worden gebruikt als geurstoffen, voor geneesmiddelen, en voor de enzymatische productie van l-fenylalanine, het uitgangsmateriaal voor peptidezoetstoffen. Natriumcinnamaat is een bekende corrosieremmer. Kaneelzuur wordt ook gebruikt als glansmiddel in cyanide-vrije zink galvanisatiebaden, als corrosieremmer bij het verwijderen van aanslag van zink en in spuitbussen, als hittestabilisator met een lage giftigheid voor poly(vinylchloride) , als cross-linking agent voor dimethyltereftalaat – ethyleenglycol copolymeer en polyurethanen, als brandwerend middel voor polycaprolactam, in wasbestendige polyurethaanlijmen voor polyestervezels, en voor verbetering van de opslagstabiliteit van droog-olie gemodificeerde alkydhars coatings.
Bereiding
Kaneelzuur wordt ook geproduceerd door Knoevenagel-condensatie van benzaldehyde met malonzuur in aanwezigheid van zwak basische katalysatoren, zoals ammoniak en aminen.
Reflux samen 10 ml benzaldehyde met 10 gram malonzuur en 40 ml 8% ethanolische ammoniakoplossing in een 100 ml rondbodemkolf voorzien van een refluxcondensor op een waterbad tot een heldere oplossing is verkregen (ongeveer 8-10 uur). Stel de opstelling in voor neerwaartse destillatie en destilleer de overmaat alcohol af. Verwarm het olieachtige residu verder tot er geen kooldioxide meer wordt gevormd. Los het residu op in 20 ml water, koel af en voeg verdund zoutzuur toe tot het zuur is. Vang het neergeslagen onverzadigde zuur op in een buchner trechter, spoel af met koud water. Herkristalliseer in heet water en vang kristallen van kaneelzuur op, m.p. 132°C.
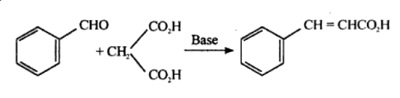
Synthese van kaneelzuur uit benzaldehyde
Inhoudsanalyse
Weeg 500 mg monster dat vooraf 3 uur in een met silicagel gevulde droger is gedroogd, nauwkeurig af; voeg 0,1mol/L waterstof toe.
Toxiciteit
GRAS (FEMA).
De acute orale LD50 bij ratten is 2,5 g/kg, en de acute dermale LD50 bij konijnen bedraagt meer dan 5 g/kg. Kaneelzuur, onverdund aangebracht op een intacte of geschaafde konijnenhuid gedurende 24 uur, was licht irriterend; een 4 % oplossing in petrolatum veroorzaakte geen sensibilisatie bij de mens.
Geperkt gebruik
FEMA (mg/kg): Frisdranken 31; Koude drank 40; Snoepgoed 30; Bakkerijproducten 36; Gom 10.
Neem matig als limiet (FDA§172.515, 2000).
Productiemethode
Commerciële synthese van kaneelzuur levert vrijwel altijd de trans-isomeer op.
De Perkin-reactie is de oudst bekende methode om kaneelzuur commercieel te produceren. In deze reactie wordt benzaldehyde gecondenseerd met azijnzuuranhydride in aanwezigheid van natriumacetaat als katalysator.
Benzalchloride reageert met alkali-acetaat in een alkalisch medium om een hoge opbrengst aan kaneelzuur te geven. Kaneelzuur kan door deze reactie in aanwezigheid van aminen zoals pyridine in meer dan 80 % opbrengst worden verkregen.
Het kan ook worden bereid door: benzoylaceton, natriumcarbonaat en bleekmiddel te mengen, waarbij natriumkaneelzuur ontstaat, gevolgd door bewerking met sulfaat.
Beschrijving
Kaneelzuur is een wit kristallijn organisch zuur, dat slecht oplosbaar is in water.
Het wordt verkregen uit kaneelolie, of uit balsems zoals storax. Het wordt ook aangetroffen in karitéboter en is de beste aanwijzing voor de milieugeschiedenis en de omstandigheden na de extractie. Het kan ook synthetisch worden gemaakt.
Kaneelzuur wordt gebruikt in smaakstoffen, synthetische indigo, en bepaalde farmaceutische producten, hoewel het vooral wordt gebruikt bij de vervaardiging van de methyl-, ethyl-, en benzylesters voor de parfumindustrie. Kaneelzuur heeft een honingachtige geur; het en zijn meer vluchtige ethylester (ethylcinnamaat) zijn smaakcomponenten in de etherische olie van kaneel, waarin het verwante cinnamaldehyde het hoofdbestanddeel is. Kaneelzuur maakt ook deel uit van de biosynthetische shikimaat- en fenylpropanoïde-routes. De biosynthese vindt plaats door de inwerking van het enzym fenylalanine ammonia – lyase (PAL) op fenylalanine.
Kaneelzuur is goed oplosbaar in benzeen, diethylether, aceton, en het is onoplosbaar in hexaan.
Kaneelzuur is ook een soort zelfremmer die door schimmelsporen wordt geproduceerd om ontkieming te voorkomen.
Chemische eigenschappen
Kaneelzuur is vrijwel reukloos met een branderige smaak, en wordt dan zoet en doet denken aan abrikoos.
Occurrence
De trans-vorm is gevonden onder de bestanddelen van de essentiële oliën van basilicum, Chinese kaneel,Melaleuca bracteata, Alpinia galanga. Het is gerapporteerd gevonden in Peru balsem, Aziatische en Amerikaanse storax en cacaobladeren. Ook wordt het aangetroffen in aardbeienvruchten, bier, cognac, sterfruit (Averrhoa carambola L) en loquat. De cis-vorm is aanwezig in de olie van Alpinia malacensis.
Gebruik
geurstof & smaakstof, antidiabetisch
Gebruik
kaneelzuur heeft zonwerende eigenschappen. Sommige fabrikanten gebruiken het ter vervanging van PABA vanwege de lagere incidentie van allergische en fototoxische reacties. Kaneelzuur wordt gevonden in kaneelbladeren en cacaobladeren, en is een essentiële olie van bepaalde paddenstoelen. Het kan allergische huiduitslag veroorzaken.
Toepassingen
Kaneelzuur is een smaakstof die bestaat uit kristallijne schubben, wit van kleur, met een geur die lijkt op honing en bloemen. het is licht oplosbaar in water, oplosbaar in alcohol, chloroform, azijnzuur, aceton, benzeen, en de meeste oliën, en alkalimetaalzouten oplosbaar in water. het wordt verkregen door chemische synthese. het wordt ook wel 3-fenylpro-penoëzuur genoemd.
Definitie
ChEBI: Een monocarbonzuur dat bestaat uit acrylzuur met een fenylsubstituent op de 3-positie. Het wordt gevonden in Cinnamomum cassia.
Voorbereiding
Er bestaan twee isomeren, trans- en cis-; het trans-isomeer is van belang voor gebruik in smaakstoffen; naast de extractie uit natuurlijke bronnen (storax), kan het als volgt worden bereid (1) uit benzaldehyde, watervrij natriumacetaat en azijnzuuranhydride in aanwezigheid van pyridine (Perkin-reactie); (2) uit benzaldehyde en ethylacetaat (Claisen-condensatie); (3) uit benzaldehyde en acetyleenchloride; (4) door oxidatie van benzylideenaceton met natriumhypochloriet.
Syntheseverwijzing(en)
Journal of the American Chemical Society, 75, p. 1068, 1953 DOI: 10.1021/ja01101a016
The Journal of Organic Chemistry, 59, p. 710, 1994 DOI: 10.1021/jo00083a006
Veiligheidsprofiel
Gif via intraveneuze en intraperitoneale weg. Matig giftig bij inslikken. Irriterend voor de huid. Brandbare vloeistof. Bij verhitting tot ontleding geeft het scherpe rook en dampen af.
Chemische synthese
Rainer Ludwig Claisen (1851-1930), Duits scheikundige, beschreef in 1890 voor het eerst de synthese van cinnamaten door aromatische aldehyden te laten reageren met esters. De reactie staat bekend als de Claisen-condensatie.
Verwijderingsmethoden
Kristalliseer het zuur uit *benzeen, CCl4, heet water, water/EtOH (3:1), of 20% waterige EtOH. Droog het bij 60o in vacuüum. Het is vluchtig met stoom.